абиотрофия штаргардта код по мкб 10
Наследственные ретинальные дистрофии
Рубрика МКБ-10: H35.5
Содержание
Определение и общие сведения [ править ]
Синонимы: Ювенильная макулярная дегенерация
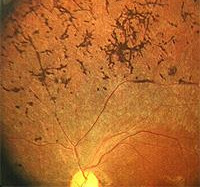
Выделяют четыре формы болезни Штаргардта в зависимости от локализации патологического процесса: в макулярной области, на средней периферии (fundus flavimaculatus), в парацентральной области, а также смешанную форму при локализации в центре и на периферии.
Этиология и патогенез [ править ]
В ПЭС происходит интенсивное накопление липофусцина. Он ослабляет окислительную функцию лизосом, увеличивает рН клеток ПЭС, что приводит к нарушению их мембранной целостности.
Клинические проявления [ править ]
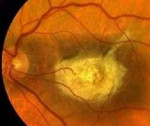
При центральной форме дистрофии Штаргардта по мере развития процесса офтальмоскопическая картина макулярной области имеет различный вид: от «битого металла» до «бычьего глаза», «кованой бронзы» и атрофии хороидеи.
Феномен «бычий глаз» офтальмоскопически виден как тёмный центр, окружённый широким кольцом гипопигментации, за которым обычно следует другое кольцо гиперпигментации. Сосуды сетчатки не изменены, ДЗН (диск зрительного нерва) бледен с темпоральной стороны, что связано с атрофией нервных волокон в папилломакулярном пучке. Фовеолярный рефлекс и макулярное возвышение (umbo) отсутствуют.
Наследственные ретинальные дистрофии: Диагностика [ править ]
Время возникновения заболевания (в детском или юношеском возрасте) может играть важную роль в его диагностике.
Гистологически отмечают увеличение количества пигмента в центральной зоне глазного дна, атрофию прилежащего ПЭС, комбинацию атрофии и гипертрофии пигментного эпителия. Жёлтые пятна представлены липофусциноподобным материалом.
При периметрии у всех больных с болезнью Штаргардта обнаруживают относительные или абсолютные центральные скотомы разной величины в зависимости от сроков и распространения процесса с раннего детского или юношеского возраста. При жёлто-пятнистом глазном дне изменений в макулярной области не отмечают, поле зрения может быть не изменено.
ЭРГ и ЭОГ. Макулярная ЭРГ снижается уже в начальных стадиях центральной формы дистрофии Штаргардта и не регистрируется в развитых стадиях.
В начальных стадиях fundus flavimaculatus ганцфельд ЭРГ и ЭОГ остаются в пределах нормы; в развитых стадиях снижаются колбочковые и палочковые компоненты ЭРГ, которая становится субнормальной, так же изменяются показатели ЭОГ. У больных при этой форме симптомы отсутствуют. Острота зрения, цветовое зрение, поле зрения находятся в пределах нормы. Темновая адаптация может быть нормальной или незначительно сниженной.
На ФАГ при типичном феномене «бычьего глаза» на нормальном фоне обнаруживают зоны «отсутствия», или гипофлюоресценции, с видимыми хориокапиллярами, «тёмную», или «молчащую», хороидею. Отсутствие флюоресценции в макулярной области объясняют накоплением липофусцина, экранирующего флуоресцеина. Участки с гипофлюоресценцией могут становиться гиперфлюоресцирующими, что соответствует зоне атрофии ПЭС.
Дифференциальный диагноз [ править ]
Сходство клинической картины различных дистрофических заболеваний макулярной области затрудняет диагностику. Дифференциальный диагноз болезни Штаргардта следует проводить с семейными друзами, fundus albipunctatus, пятнами сетчатки Кандори, доминантной прогрессирующей фовеальной дистрофией, колбочковой, колбочко-палочковой и палочко-колбочковой дистрофией, ювенильным ретиношизисом, вителлиформной макулярной дистрофией, приобретёнными лекарственными дистрофиями (например, хлороквиновой ретинопатией).
Наследственные ретинальные дистрофии: Лечение [ править ]
Патогенетически обоснованного лечения нет.
Информация для пациента (краткие рекомендации)
Рекомендуют ношение солнцезащитных очков в качестве профилактической меры от повреждающего действия света, применение общеукрепляющей витаминотерапии.
Острота зрения снижается прогрессивно, особенно быстро в детском и юношеском возрасте, что зависит от размера выраженности изменений в макулярной области.
Профилактика [ править ]
Прочее [ править ]
Синонимы: вителлиформная макулярная дистрофия Беста.
В северной Швеции и Дании частота возникновения патологии оценивется на уровне 1/5000 и 1/67000 соответственно. Заболеванию больше подвержены мужчины, чем женщины (3:1).
Болезнь Беста наследуется аутосомно-доминантно с полной пенетрантностью.
Течение болезни бессимптомное. Болезнь Беста обнаруживают случайно при осмотре детей в возрасте 5-15 лет. Изредка пациенты предъявляют жалобы на затуманивание зрения, затруднения при чтении текстов с мелким шрифтом, метаморфопсии. Острота зрения варьирует в зависимости от стадии болезни от 0,02 до 1,0. Изменения в большинстве случаев асимметричные, двусторонние.
В зависимости от изменений в макулярной области, определяемых офтальмо-скопически, выделяют пять стадий заболевания, хотя развитие болезни не всегда проходит через все стадии.
• Стадия 1 (превителлиформная). Характеризуется минимальными нарушениями пигментации в виде мелких жёлтых очажков в макуле.
• Стадия 2 (вителлиформная). Классическая вителлиформная киста в макуле.
• Стадия 3. Разрыв кисты и различные фазы резорбции её содержимого.
• Стадия 4. Резорбция содержимого кисты,
• Стадия 5. Формирование фиброглиального рубца с субретинальной неоваскуляризацией или без неё.
Диагноз у пациентов с болезнью Беста устанавливают на основании результатов офтальмоскопии, ФАГ, ЭРГ и ЭОГ. В трудных случаях в диагностике может помочь обследование других членов семьи.
Пренатальная диагностика и преимплантационная генетическая диагностика возможны для семей, в которых известны мутации, вызывающие заболевание.
Лечение является симптоматическим и включает использование средств коррекции зрения для лиц со значительным его снижением. Рекомендовано ежегодное офтальмологическое обследование для лиц всех возрастов. Следует избегать курения, так как оно увеличивает риск неоваскулярной макулярной дегенерации. Для купирования субфовеальной хориоидальной неоваскуляризации могут быть использованы фотодинамическая терапия с использованием вертепорфина, непосредственно лазерная фотокоагуляция или анти-VEGF препараты (бевацизумаб). Также может быть использована транскорнеальная электрическая ретинальная стимуляция.
Ухудшение зрительных функций по мере развития и резорбции желточной кисты.
Вителлиформная макулярная дистрофия взрослых
Мутация обнаружена в гене периферина (RDS). В отличие от болезни Беста, патологии в фовеолярной области при вителлиформной макулярной дистрофии взрослых развиваются в зрелом возрасте, затрагивают меньшие участки и не прогрессируют.
ЭОГ, как правило, не изменена.
Развивающееся в раннем детском возрасте наследственное заболевание, характеризующееся дистрофическими изменениями пигментного эпителия и фоторецепторов и имеющее типичную картину глазного дна с пигментными очагами, схожими с пигментными костными тельцами.
а) Генетические типы: аутосомно-доминантный, аутосомно-рецессивный, сцепленный с Х-хромосомой.
б) Клинические формы: типичная (пигментный ретинит); атипичная (беспигментная форма пигментного ретинита, секторальный подковообразный пигментный ретинит, инвертированный (центральная форма); белоточечный пигментный ретинит (retinitis punctata albescens).
Этиология и патогенез
Более 3000 мутации в более чем 57 различных генов или локусов в настоящее время известно.
Большинство мутаций, приводящих к дегенерации сетчатки, происходит в генах, кодирующих синтез белков каскада фототрансдукции и обмена ацетата ретинола (витамина А) (родопсина, α- и β-субъединиц циклического гуанозинмонофосфата, арестина, АТФ-связывающего кассетного переносчика ретиналя, G-протеина, клеточного ретинальдегида, связывающего протеин, и гена RPGR-трансдукции и др.), а также в генах, ответственных за фактор транскрипции.
Различают аллельную и неаллельную разновидности пигментного ретинита.
В связи с поражением палочковой системы возникает ночная слепота (отсутствие ночного зрения, никталопия). Темновая адаптация нарушена уже в начальной стадии заболевания, порог световой чувствительности повышен как в палочковой, так и в колбочковой части.
К другим формам пигментного ретинита относят: пигментный ретинит инвертированный, пигментный ретинит без пигмента, белоточечный пигментный ретинит (retinitis punctata albescens) и псевдопигментный ретинит. Каждая из этих форм имеет характерную офтальмоскопическую картину и ЭРГ-симптоматику.
Лечение в первую очередь направлено на замедление прогрессирования заболевания. Витамин А и лютеин используется в качестве антиоксидантов. Ацетазоламид внутрь или местно дорзоламид используются для уменьшения кистозного отека макулы. Экстракция хрусталика требуется, если катаракта снижает остроту зрения. Солнцезащитные очки с фильтрацией коротких волн улучшает зрение.
Определение и общие сведения
Синдром Бера включает в себя атрофию зрительного нерва и сопутствующие неврологические симтомы. Синдром Бера клинически похож на синдром Костеффа, но без метаболических нарушений.
Синдром Бера наследственное заболевание, передается аутосомно-рецессивно. Распространненость неизвестна, оба пола в равной степени подвержены заболеванию.
Атрофия зрительного нерва приводит к нарушению остроты зрения от умеренной до тяжелой степени тяжести, которое проявляется в раннем возрасте. Нарушение остроты зрения часто сопровождается сенсорным нистагмом.
Неврологические симтомы имеют внутри- и межсемейную изменчивость. Они могут включать в себя миоклоническую эпилепсию, прогрессирующую спастическую параплегию вследствие участия пирамидного тракта, дизартрию, экстрапирамидные симптомы, атаксию, недержание мочи, умственную отсталость, потерю чувствительности вследствие поражения задних столбов спинного мозга и мышечные контрактуры (в основном в нижних конечностях). Эти неврологические симптомы проявляются постепенно в детстве и становятся заметны во втором десятилетии. К этому возрасту большинство больных с синдромом Бера передвигаются только при помощи ходунков.
Часто пациентам требуется хирургическая коррекция контрактур ахиллова сухожилия и большой приводящей мышцы бедра.
Синонимы: синдром пигментный ретинит-тугоухость, синдром Ашера
Определение и общие сведения
Синдром Ушера характеризуется сочетанием нейросенсорной глухоты (обычно врожденной) с пигментным ретинитом и прогрессирующей потерей зрения.
Этиология и патогенез
МКБ-10
Общие сведения
Абиотрофия сетчатки (дегенерация сетчатки, дистрофия сетчатки) – патология органа зрения, при которой развивается дистрофия сетчатой оболочки глаза. Может быть частью симптомокомплекса некоторых наследственных заболеваний, выступать как самостоятельная патология, в некоторых случаях возможна вторичная дегенерация после травм и других воздействий.
Причины
Этиология абиотрофии сетчатки различается в зависимости от конкретного типа заболевания. Общий механизм – мутация определенного гена или генов, которые кодируют специфические белки, участвующие в жизнедеятельности сетчатой оболочки глаза. При этом патогенез большинства форм изучен недостаточно.
Пигментная дистрофия сетчатки. Причиной наиболее распространенной формы абиотрофии сетчатки – пигментной дистрофии – могут являться более 150 вариантов мутаций в нескольких десятках генов, большинство из которых наследуются по аутосомно-доминантному типу. Почти четверть всех случаев пигментной абиотрофии сетчатки обусловлена различными мутациями в гене белка опсина. В гене белка фоторецепторов CRB1 мутация имеет рецессивный характер наследования, а в генах RP2 и RPGR – сцепленный с Х-хромосомой.
Существует редчайшая форма пигментной абиотрофии сетчатки с мутацией в митохондриальной ДНК и, следовательно, наследованием от матери потомству. Несмотря на огромное количество разнообразных вариантов первичного нарушения при пигментном ретините, патогенез заболевания в целом одинаков – происходит нарушение утилизации отработанных палочек, в результате чего они становятся источником токсинов в сетчатке. Из-за того, что концентрация палочек растет по направлению к периферии сетчатой оболочки, патологические изменения начинаются именно там, образование новых фоточувствительных клеток замедляется, что и ведет к снижению светочувствительности.
Желтопятнистая абиотрофия сетчатки (болезнь Штаргардта) также обусловлена мутациями нескольких генов. Наиболее распространенная форма желтопятнистой дегенерации сетчатой оболочки связана с нарушением структуры белка ABCA4, который выполняет транспортные и энергетические функции в мембранах фоторецепторов. Эта форма заболевания наследуется по аутосомно-рецессивному типу. Изменение структуры трансмембранного белка ABCA4 приводит к накоплению в сетчатке токсичных метаболитов (в частности, липофусцина), что и вызывает дистрофию светочувствительного слоя.
Другой вариант болезни Штаргардта с аутосомно-доминантным наследованием обусловлен изменением структуры белка ELOVL4, который контролирует образование длинноцепочных жирных кислот в тканях глаза. В этом случае дегенерация фоторецепторов связана с нарушением синтеза некоторых компонентов их мембран. Еще один тип желтопятнистой абиотрофии сетчатки ассоциируется с мутацией гена PROM1. Патогенез нарушений в этом случае досконально не изучен.
Абиотрофия сетчатки Беста вызвана мутациями гена BEST1, продуктом транскрипции которого является белок бестрофин, относящийся к классу анионных каналов. Наследование аутосомно-доминантное, патогенез дистрофии неизвестен.
Врожденная стационарная ночная слепота является генерализованной абиотрофией сетчатки с преимущественным поражением палочек, она также сопровождается другими нарушениями органа зрения – косоглазием, катарактой. Выделяют полную и неполную формы врожденной стационарной ночной слепоты, обе наследуются по Х-сцепленному механизму.
Полный тип обусловлен мутацией гена NYX, кодирующего белок, обеспечивающий передачу возбуждения от палочек биполярным клеткам. В результате этого передача информации от фоторецепторов нарушается, возникает гемералопия с практически полным отсутствием зрения в темноте, при этом острота и цветовое восприятие обычно не страдают.
Неполная форма связана с мутацией гена CACNA1F, продуктом которого является схожий белок, но он имеется как у палочек, так и у колбочек. При этом, однако, передача импульса не блокируется полностью, поэтому сумеречное зрение только ослаблено, но также страдает острота и цветовое восприятие.
Классификация
В офтальмологии все наследственные формы дистрофии сетчатой оболочки глаза делят на три группы:
При этом из-за большого количества различных мутаций вышеописанное разделение несколько условно. Так, некоторые формы пигментной дистрофии могут приобретать генерализованный характер, а при мутации гена PROM1 (четвертый тип болезни Штаргардта) абиотрофия от центральных областей сетчатки может распространяться на периферию.
Симптомы абиотрофии сетчатки
Симптомы абиотрофии сетчатки довольно вариабельны из-за большого количества различных мутаций, которые приводят к развитию данной патологии. Но в тоже время, между различными вариантами дистрофии в пределах одной группы (периферические, центральные или генерализованные абиотрофии) имеется ряд схожих проявлений.
Периферические абиотрофии сетчатки (пигментная дистрофия, белоточечная абиотрофия) начинаются с преимущественного поражения палочек, поэтому одним из первых симптомов заболевания будет гемералопия. С прогрессированием патологии, при дальнейшем разрушении палочек, снижение ночного зрения может перерасти в его полную потерю – никталопию. Нарушается периферическое зрение, возникает концентрическая скотома, после которой поле зрения сужается настолько, что становится «трубчатым».
При белоточечной абиотрофии сетчатки более тяжелые нарушения чаще всего не развиваются, дневное зрение и цветовосприятие остается без изменений. В ряде случаев пигментной дистрофии в патологический процесс вовлекаются и колбочки, что ведет к падению дневного зрения, снижению его остроты и иногда полной слепоте. Течение заболевания может занимать десятки лет, хотя встречаются и быстротечные, а также ювенильные формы.
Центральные абиотрофии сетчатки характеризуются преимущественным поражением колбочек, концентрация которых наиболее высокая в области желтого пятна – поэтому их также называют макулодистрофиями. На первый план выступает резкое снижение остроты зрения, нарушается восприятие цветов, при полном разрушении фоторецепторов в центре глазного дна развивается центральная скотома.
Если патологический процесс не распространяется на периферические области сетчатки, то периферическое и сумеречное зрение затрагивается слабо. При формах абиотрофии, характеризующихся очаговым поражением фоторецепторов, развиваются слепые пятна в поле зрения. При особо тяжелых формах может возникать атрофия волокон зрительного нерва и полная слепота.
Полная форма врожденной стационарной ночной слепоты характеризуется выраженной никталопией с сохранением дневного зрения и цветового восприятия. При этом прогрессирования заболевания не происходит. Симптомами неполной формы ВСНС является умеренная гемералопия, пониженная острота зрения, аномалии цветового зрения, сложность адаптации к пониженной освещенности.
Диагностика
Пациенты с абиотрофией сетчатки должны быть проконсультированы генетиком и офтальмологом. Определение дистрофических процессов в сетчатой оболочке глаза производится на основании данных осмотра глазного дна, электроретинографии, исследования остроты зрения и цветового восприятия. Немаловажную роль играет изучение наследственного анамнеза, а также генетические исследования на предмет выявления мутаций в генах, ассоциированных с тем или иным типом абиотрофии сетчатки.
При пигментной дистрофии по периферии глазного дна выявляются очаги отложения пигмента, также они могут наблюдаться и на центральных участках при соответствующей форме заболевания. Отмечается сужение артериол сетчатки, а на поздних этапах возникает атрофия капилляров сосудистой оболочки глаза. В ряде случаев выявляется восковидная атрофия диска зрительного нерва. Электроретинография показывает значительное снижение амплитуды всех волн, что свидетельствует о резком уменьшении количества фоторецепторов в сетчатке. Секвенирование ДНК с целью выявления мутаций наиболее часто производится в отношении генов RP1, RHO, RDS, RLBP1, PRPF8 и ряда других.
Белоточечная абиотрофия сетчатки при осмотре глазного дна характеризуется наличием белых, иногда с металлическим оттенком, очагов, расположенных по периферии сетчатки. Артериолы сетчатой оболочки сужены, пигментные отложения представлены в единичном количестве, выявляется побледнение диска зрительного нерва. Изменения на электроретинографии выражены слабо и не являются надежным диагностическим критерием. Генетическая диагностика представлена секвенированием гена PRPH2.
При болезнях Штаргардта и Беста при офтальмоскопии обнаруживаются атрофические очаги светлого оттенка, нередко окруженные отложениями пигмента. Размеры и количество очагов может значительно отличаться и отражает тяжесть поражения сетчатой оболочки глаза. В основном они располагаются в центральных зонах, но могут распространяться и на периферию. На электроретинографии выявляется резкое снижение амплитуды волны А, что свидетельствует о преимущественном разрушении колбочек. Генетическая диагностика сводится к выявлению мутаций в генах ABCA4 и CNGB3 и изучению наследственного анамнеза.
Лечение абиотрофии сетчатки
Специфического этиотропного лечения любой формы абиотрофии сетчатки на сегодняшний момент не существует. В качестве поддерживающего лечения, задерживающего прогрессирование заболевания, используются препараты витаминов А, Е, рибофлавина. Сосудорасширяющие средства позволяют улучшить кровоснабжение сетчатки, что также замедляют дистрофические процессы.
В последние годы появились данные об успешном применении бионических имплантатов сетчатки (Argus, Argus 2), позволивших частично вернуть зрение пациентам, полностью утратившим его из-за абиотрофии. Некоторые наработки в области использования стволовых клеток, генной терапии также преследуют цель найти метод лечения абиотрофии сетчатки.
Прогноз
Из-за большого количества мутаций, которые являются причиной абиотрофии, и различного клинического течения дистрофических процессов в сетчатке прогноз практически всегда неопределенный. Некоторые типы пигментной дистрофии могут ограничиться гемералопией и нарушением периферического зрения, тогда как другие формы этой патологии ведут к полной слепоте. Путем приема препаратов витамина А в ряде случаев удается замедлить прогрессирование абиотрофии сетчатки, по некоторым данным использование солнцезащитных очков также позволяет достичь аналогичного результата.
Болезнь Штаргардта

Изменения в виде желтовато-беловатых точек и полос с изменениями в макулярной области или без них A. Franceschetti обозначил термином «fundus flavimaculatus». В литературе термины «болезнь Штаргардта» и «фундус флавимакулятус» нередко объединяют (Stargardt disease/fundus flavimaculatus), подчеркивая тем самым предполагаемое единство происхождения и/или переход из одной формы заболевания (болезнь Штаргардта) в другую (фундусс флавимакулятус) по мере ее развития.
Если снижение зрения, обусловленное типичными дистрофическими изменениями желтого пятна, начинается в первые две декады жизни, то предпочтительнее употреблять термин «болезнь Штаргардта». Если же изменения появляются в центральных и периферических отделах сетчатки в более позднем возрасте и заболевание острее прогрессирует, то рекомендуется использовать термин «фундус флавимакулатус».

Симптомы (в порядке появления):
Классификация
Наряду с классическим выделением двух типов болезни Штадгардта, включающих дистрофию макулярной области с и без фундус флавимакулатус, редложено несколько других классификаций, основанных на вариациях клинической картины глазного дна.
Так, K.G. Noble и R.E. Саrr (1971) выделили четыре типа заболеваний:
Генетические исследования
Дистрофия Штаргардта наиболее часто наследуется по аутосомно-рецессивному типу, однако описано много семейств, в которых передача болезни осуществляется аутосомно-доминантным путем. Существует мнение, что доминантный тип наследования свойствен главным образом III и IV типам болезни Штаргардта.

Белок RmP является интегральным мембранным гликопротеином с молекулярным весом 210 кДа, который локализуется по краю дисков наружных сегментов зрительных клеток. Показано, что RmP относится к суперсемейству ABC-переносчиков АТФ-связывающих кассет, которые стимулируют гидролиз АТФ и влияют на АТФ-зависимое перемещение специфических субстратов через клеточные мембраны.
Выявлено, что гены для нескольких членов суперсемейства АВС-переносчиков вовлечены в развитие ряда наследственных заболеваний сетчатки человека. Так, при аутосомно-доминантном типе наследования болезни Штаргардта показана локализация мутированных генов на хромосомах 13q и 6ql4, а также картирован ген для новой доминантной формы Штаргардт-подобного заболевания сетчатки (возможно, относящегося к типу IV) на хромосоме 4р между маркерами D4S1582 и D4S2397.
Человеческий ген RmP картирован между маркерами D1S424 и D1S236 на хромосоме lp (Ip21-pl3). Там же локализованы гены наиболее распространенной аутосомно-рецессивной формы дистрофии Штаргардта и фундус флавимакулятус, а место гена аутосомно-рецессивной формы пигментного ретинита RP19 определено между маркерами D1S435—D1S236 на хромосоме lp. В исследовании S.M. Azarian и соавт. (1998) установлена полная тонкая интрон-экзонная структура гена ABCR.
С помощью иммунофлюоресцентной микроскопии и вестерн-блоттинг-анализа показано, что ABCR присутствует в фовеальных и перифовеальных колбочках, в связи с чем полагают, что потеря центрального зрения при дистрофии Штаргардта может быть прямым следствием фовеальной колбочковой дегенерации, вызванной мутациями гена ABCR.
Выявлено также, что мутации ABCR имеются в субпопуляции пациентов с неэкссудативной формой макулярной дегенерации, связанной с возрастом (АМД) и колбочко-палочковой дистрофией, что позволяет предполагать наличие генетически обусловленного риска развития АМД у родственников больных с болезнью Штаргардта. Однако это утверждение поддерживают не все исследователи, хотя не подвергается сомнению тот факт, что фенотипические и генотипические проявления болезни Штаргардта и АМД связаны с мутациями гена ABCR.
J.M. Rozet и соавт. (1999), обследуя семейство, имеющее среди своих членов больных и с пигментным ретинитом, и с болезнью Штаргардта, показали, что гетерозиготность гена ABCR приводит к развитию дистрофии Штаргардта, а гомозиготность — к развитию пигментного ретинита.
Таким образом, результаты генетических исследований последних лет свидетельствуют о том, что, несмотря на явные различия в клинической картине пигментного ретинита, болезни Штаргардта, фундус флавимакулятус и АМД, они являются аллельными нарушениями локуса ABCR.
Широкий диапазон фенотипических проявлений дистрофии Штаргардта и возраста выявления клинических признаков (от первой до седьмой декады жизни), наблюдаемых даже в одной семье, делает трудным дифференциальный диагноз и прогноз изменений остроты зрения. Данные ангиографии, анамнез заболевания, сниженные зрительные функции, измененные колбочковые компоненты в ЭРГ, специфика изменений локальной и мультифокальной ЭРГ помогают в постановке диагноза.
Таким образом, в последние годы все большее значение для диагностики придают результатам генетических исследований. Так, G.A. Fishman и соавт. (1999), обследовав большую группу больных с дистрофией Штаргардта и фундус флавимакулятус, имеющих мутации гена ABCR, показали, что вариабельность фенотипических проявлений определенным образом зависит от вариации специфической последовательности аминокислот. По результатам флюоресцентной ангиографии, офтальмоскопии, электроретинографических и периметрических исследований ими было выделено три фенотипа заболевания
В связи с тем что мутации ABCR сопровождаются различными фенотипическими проявлениями, полагают, что успехи в идентификации корреляций между специфическими мтациями гена и клиническими фенотипами облегчат консультирование больных и по поводу прогноза остроты зрения.
Все эти исследования направлены не только на раскрытие тонких механизмов генетических заболеваний сетчатки, но и на поиск возможной их терапии.
Клиническая картина

При фундус флавимакулятус поле зрения может быть не изменено, особенно в первые две декады жизни, у всех больных с болезнью Штаргардта выявляют относительные или абсолютные центральные скотомы разной величины в зависимости от распространения процесса в макулярной области.
Цветовое зрение
У большинства пациентов с болезнью Штаргардта I типа отмечается дейтеранопия; при II типе болезни Штаргардта нарушения цветового зрения более выраженные и не поддаются классификации. Вид цветоаномалии, по-видимому, зависит от того, какой тип колбочек преимущественно вовлечен в патологический процесс, поэтому при фундус флавимакулятус цветовое зрение может быть не изменено либо отмечается красно-зеленая дихромазия.
Темновая адаптация
По данным О. Gelisken, J.J. De Jaey (1985), из 43 пациентов с болезнью Штаргардта и фундус флавимакулятус у 4 был повышен конечный порог световой чувствительности, у 10 отсутствовал колбочковый отрезок кривой темновой адаптации.
Пространственная контрастная чувствительность
Контрастная чувствительность, on- и off-активность колбочковой системы, оцениваемые по времени сенсомоторной реакции при предъявлении стимула темнее и светлее фона, отсутствуют в центральной области сетчатки с некоторой сохранностью off-чувствительности в зоне 10° от центра.
Электроретинография и электроокулография

По данным литературы, в начальных стадиях дистрофии Штаргардта и фундус флавимакулятус общая, или ганцфельд, ЭРГ нормальна. Однако применение различных методических приемов электроретинографии позволяет оценить топику функциональных нарушений в сетчатке на уровне ее различных слоев и отделов.
Применение зональной электроретинографии позволило выявить угнетение реакции наружного слоя сетчатки (фоторецепторов) не только в макулярной зоне, но и в парамакулярном и периферическом отделах в ранних стадиях болезни Штаргардта при сохранности проксимальных слоев сетчатки.
Снижение амплитуд а- и 1а волн ЭРГ в разных зонах сетчатки (центр, парацентр, периферия) свидетельствует о генерализованном поражении всего фоторецепторного слоя обеих систем (колбочковой и палочковой) уже в первой стадии заболевания. Развитие процесса сопровождается распространением патологических изменений в глубь сетчатки, что выражается в увеличении частоты выявления и степени выраженности изменений всех компонентов ЭРГ.
Однако уже в начальных (I-II) стадиях болезни Штаргардта выявляют большую степень угнетения колбочковых компонентов ЭРГ по сравнению с палочковыми.
R. Itabashi и соавт. (1993) представили результаты обследования большой группы больных с болезнью Штаргардта, сравнив степень угнетения различных компонентов ЭРГ.
Согласно классификации, предложенной K.G. Noble и R.E. Сагг (1971), были выделены несколько групп больных по стадиям заболевания: 1-4. Средние амплитуды всех компонентов ЭРГ оказались ниже нормальных значений при более выраженных изменениях колбочковой системы сетчатки. Фотопическая b-волна составляла 57,4 % от нормы, скотопическая b-волна — 77,9 %, ответы на «белый» мелькающий стимул 32 Гц — 78,9 %, а-волна — 87,7 %, b-волна — 95,8 % от нормы. Наибольшее снижение всех компонентов ЭРГ отмечено у больных группы 3.
Временные параметры также были изменены; удлинение пикового времени наиболее значительно для а-волны, особенно у больных группы 3. Для этой стадии характерно также наиболее частое выявление субнормального свето-темнового коэффициента ЭОГ (73,5 %). По мнению авторов, прогноз у больных в группе 3 наиболее неблагоприятен.
Наблюдение за больными на протяжении 7-14 лет позволило проследить динамику электрофизиологических показателей в сопоставлении с клиникой процесса. Более выраженные офтальмоскопические изменения сопровождались снижением как электроретинографических, так и электроокулографических показателей. Эти результаты согласуются с мнением других исследователей, которые на основании электроретинографических и гистологических данных предполагают первоначальное поражение в РПЭ при фундус флавимакулятус и дальнейшее поражение фоторецепторов сетчатки при дистрофии Штаргардта.
В литературе имеются определенные расхождения в результатах электроокулографии. Чаще всего отмечают нормальную или несколько сниженную ЭОГ у большинства больных с фундус флавимакулятус и дистрофией Штаргардта. Однако ряд исследователей отмечают высокий процент субнормальной ЭОГ по величине коэффициента Ардена: у 75—80 % больных ФФ. Следует учитывать, что в большинстве публикаций приведены результаты обследования немногочисленных групп пациентов: от 3 до 29.
G.A. Fishman (1976, 1979) провел корреляцию между стадиями фундус флавимакулятус и результатами ЭОГ. Он показал, что при заболевании I—II стадий у всех обследованных ЭОГ не изменена (28/28), тогда как при III—IV стадиях у 90 % больных она субнормальна. По мнению G.A. Fishman и соавт (1976 1977 1979), лишь в случае поражения патологическим процессом значительной площади сетчатки ЭОГ будет аномальной. Другие исследователи также отмечают отсутствие изменений ЭОГ у подавляющего большинства больных с фундус флавимакулятус. Не исключено что на результаты исследований оказывают влияние различия в методических приемах, несмотря на попытки их стандартизации.
Таким образом, электрофизиологические исследования скорее позволяют выявить наличие и степень выраженности изменений колбочковой и палочковой систем сетчатки, а также оценить состояние РПЭ, чем помогают при дифференциальной диагностике болезни Штаргардта и фундус флавимакулятус.
Дифференциальный диагноз
Клиническая картина при некоторых наследственных заболеваниях может быть схожа с таковой при болезни Штаргардта. К таким заболеваниям относится доминантная прогрессирующая фовеальная дистрофия, колбочко-палочковая и палочко-колбочковая (retinitis pigmentosa) дистрофии, ювенильный ретиношизис. Атрофическая макулярная дегенерация описана при различных спиноцеребральных и церебральных спастических нарушениях, в том числе при олигопонтоцеребральной атрофии. Подобные морфологические находки описаны и при ненаследственных заболеваниях, например при хлорохиновой ретинопатии или глазных проявлениях тяжелого токсикоза беременных.
На основании различий картины глазного дна, возраста, начала заболевания, данных функциональных методов исследования S. Merin (1993) выделил два основных типа болезни Штаргардта.
Болезнь Штаргардта I типа
Этот тип наиболее соответствует первоначально описанной болезни Штаргардта. Это ювенильная наследственная макулодистрофия, клинические проявления которой наблюдаются у детей уже в возрасте 6-12 лет. С одинаковой частотой заболевают мальчики и девочки, наследственная передача осуществляется по аутосомно-рецессивному типу.
Заболевание проявляется билатерально и симметрично. В развитых стадиях фовеальный рефлекс отсутствует. Изменения на уровне пигментного эпителия сетчатки (РПЭ) проявляются в виде скопления в центре коричневатого пигмента, окруженного участками гипер- и депигментации. Клиническая картина напоминает «бычий глаз».
При флюоресцентной ангиографии подтверждают типичный феномен «бычьего глаза». Темный, не пропускающий флюоресцеина центр окружен широким кольцом гипофлюоресцирующих точек, за которым обычно следует другое кольцо гиперпигментации. Такая картина объясняется увеличением количества пигмента в центральной зоне глазного дна, атрофией прилежащих клеток РПЭ и комбинацией атрофии и гипертрофии пигментного эпителия. Отсутствие флюоресцеина в макулярной области называют «молчащей хороидеей» или темной хороидеей и объясняют накоплением кислых мукополисахаридов в РПЭ. По мнению D.A. Klein и А.Е. Krill (1967), феномен «бычьего глаза» выявляют почти у всех больных с болезнью Штаргардта I типа.
По мере прогрессирования заболевания острота зрения снижается, в результате чего развивается слабовидение. Если на ранних этапах болезни ЭРГ и ЭОГ сохраняются нормальными в развитых стадиях снижаются ответы колбочковой системы по данным ЭРГ и становятся умеренно субнормальными показатели ЭОГ. В связи с поражением преимущественно колбочковой системы у больных нарушается и цветовое зрение, чаще по типу дейтеранопии.
В более поздних стадиях болезни Штаргардта выявлено исчезновение большей части фоторецепторов и клеток РПЭ из макулярной области сетчатки. При этом часть клеток РПЭ находилась в стадии дегенерации с накоплением липофусцина, по краям участков атрофии наблюдалась гиперплазия клеток РПЭ.
F. Schutt и соавт. (2000) показали, что при заболеваниях сетчатки, связанных с интенсивным накоплением липофусцина, в том числе при болезни Штаргардта, АМД и старении сетчатки, определенную роль в нарушение функции РПЭ вносит ретиноидный флюоресцентный компонент липофусцина А2-Е (N-ретинилиден-N-ретинил-этанол-амин). Он ослабляет деградативную функцию лизосом и увеличивает интрализосомальную рН клеток РПЭ, приводя к потере их мембранной целостности. Кроме лизосомотропических свойств показаны фотореактивные свойства А2-Е, его фототоксичность.
Болезнь Штаргардта II типа
В отличие от I типа, помимо типичных изменений в макулярной области сетчатки, на глазном дне имеются множественные и распространенные пятна ФФ, которые могут достигать экватора. Заболевание начинается несколько позже, хотя это может быть связано с тем, что снижение остроты зрения при II типе болезни Штаргардта происходит медленнее и вследствие этого пациенты позже обращаются к окулисту. В связи с тем, что при болезни Штаргардта II типа отмечается больше изменений, выходящих за границы макулярной области, электрофизиологические данные отличаются от таковых при I типе.
Так, в ЭРГ значительно снижены ответы палочковой системы. Показатели ЭОГ также изменены в большей степени. Наличие в высоком проценте случаев за пределами макулярной области (желтого пятна) желтоватых пятен затрудняет четкое разделение болезни Штаргардта и ФФ.
Фундус флавимакулятус
Параллельно этому картина, выявляемая при флюоресцентной ангиографии, становится иной: участки с гиперфлюоресценцией становятся гипофлюоресцирующими. На последующих этапах развития заболевания атрофия РПЭ проявляется как исчезновение отдельных пятен и их замена на нерегулярные участки гипофлюоресценции.
Подобные изменения пятен при фундус флавимакулятус (ФФ) характерны для обоих типов болезни Штаргардта, однако при «чистой форме» ФФ они менее выражены.
Начало заболевания, а скорее всего время его выявления, не зависит от возраста. Предполагается аутосомно-рецессивный тип наследования ФФ, однако в ряде случаев не удается установить наследственную природу данной патологии.