амиотрофия персонейджа тернера код по мкб
Невралгическая амиотрофия
Рубрика МКБ-10: G54.5
Содержание
Определение и общие сведения [ править ]
Невралгическая амиотрофия является редким расстройством периферической нервной системы, характеризуется внезапным началом сильной боли в верхней конечности с последующей быстрой мультифокальной моторной слабостью и атрофией и медленным восстановлением в течение от нескольких месяцев до нескольких лет. Невралгическая амиотрофия включает в себя как идиопатический вариант (синдром Персонейджа-Тернера) и наследственную форму.
Общая распространенность оценивается в 1 / 50000-1 / 30000, вероятно этот показатель занижен. Наследственная форма встречается в 10 раз реже, чем идиопатическая.
Невралгическая амиотрофия Персонейджа-Тернера
Синонимы: острый плечелопаточный паралич, синдром Персонейджа-Тернера
Описали синдром в 1948 г. английские врачи Parsonage и Turner.
Этиология и патогенез [ править ]
Этиология и патогенез невралгической амиотрофии не уточнены. Может возникать после вакцинации или введения сыворотки. Есть мнение, что определенную роль в развитии невралгической амиотрофии Персонейджа-Тернера играют переохлаждение, переутомление, вирусные инфекции, аллергия, шейный остеохондроз, компрессии спинномозговых корешков СV-СVI и одноименных корешковых артерий, при этом предполагается развитие демиелинизирующей плексопатии.
Наследственная форма в 50% случаев связана с точечной мутацией или дублированием гена восприимчивости SEPT9 (17q25.3).
Клинические проявления [ править ]
Проявляется чаще у мужчин острой болью в надплечье, лопатке, области плечевого сустава и верхней трети плеча. Она продолжается 3-15 сут и стихает. К этому времени развивается периферический парез (реже паралич) мышц плечевого пояса и проксимального отдела руки (передней зубчатой, надостной и подостной, трапециевидной, дельтовидной мышц). Атрофия и слабость мышц прогрессируют в течение 1-3 мес. Больные не могут поднять и отвести плечо, отмечается грубое отхождение лопатки, при вытянутой руке лопатка становится перпендикулярно к грудной стенке. В дерматомах отмечают нарушения чувствительности.
Невралгическая амиотрофия: Диагностика [ править ]
Изменения на спондилограммах при ней не характерны. Кровь нормальна, иногда отмечается некоторое повышение содержания белка в ЦСЖ.
Дифференциальный диагноз [ править ]
Невралгическая амиотрофия: Лечение [ править ]
Лечение в острой стадии включает в себя купирование болевого синдрома. Преднизолон внутрь уменьшает продолжительность болевого синдрома и ускоряет выздоровление, если назначается в течение первой недели.
Прогноз в большинстве случаев благоприятный. Сила мышц начинает восстанавливаться через 9-12 мес, полное выздоровление в 70-90% случаев происходит за 2-3 года.
Другие наследственные спинальные мышечные атрофии
Общая информация
Краткое описание
Протокол «Другие наследственные спинальные мышечные атрофии»
Коды по МКБ-10: G 12.1
Прогрессирующий бульбарный паралич у детей (Фасио-Лонде)
Спинальная мышечная атрофия:
— детская форма тип I;
— юношеская форма тип III (Кугельберга-Веландера).
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
1. Спинальная амиотрофия I типа (спинальная амитрофия раннего детского возраста, или болезнь Верднига-Гоффмана).
2. Спинальная амиотрофия II типа (спинальная амитрофия детского возраста).
3. Спинальная амитрофия III типа (болезнь Кугельберга-Веландер).
4. Бульбоспинальная амиотрофия Кеннеди (форма взрослых).
Диагностика
Диагностические критерии
Жалобы и анамнез: слабое шевеление плода, с рождения генерализованная мышечная гипотония, атрофии, фасцикулляции мышц, слабый крик, вялое сосание, дисфагии, задержка моторного развития; возможны деформации и контрактуры суставов.
Спинальная амиотрофия II типа характеризуется началом заболевания в возрасте от 6 мес. до 1 года и более медленным прогрессированием, тип наследования аутосомно-рецессивный.
Спинальная амиотрофия III типа развивается в возрасте 2-12 лет, в большинстве случаев прогрессирует медленно, тип наследования аутосомно-рецессивный.
Лабораторные исследования: общий анализ крови и мочи без патологии.
Показания для консультации специалистов:
Минимум обследования при направлении в стационар:
— общий анализ крови;
Основные диагностические мероприятия:
1. Общий анализ крови (6 параметров).
3. Осмотр психолога, логопеда.
5. Осмотр ортопеда, протезиста.
6. Осмотр физиотерапевта.
7. Осмотр врача ЛФК.
Дополнительные диагностические мероприятия:
2. УЗИ органов брюшной полости.
3. Компьютерная томография.
Дифференциальный диагноз
Признак
Спинальная мышечная атрофия
Структурные миопатии
ДЦП, атонически-астатическая форма
Генерализованная мышечная гипотония, атрофии мышц и фасцикуллярные подергивания в мышцах спины, туловища, проксимальных отделах верхних и нижних конечностей, гипорефлексия до арефлексии, задержка моторного развития при сохранном психо-речевом развитии
Мышечная гипотония, гипорефлексия с последующей гиперрефлексией, задержка психо-рече-моторного развития, судороги, деформации (сколиоз, деформации грудной клетки)
Дебют заболевания в 6-12 месяцев жизни; в 2-12 лет, на 4-5 десятилетие жизни
Дебют заболевания в неонатальном периоде, задержка моторного развития
Дебют заболевания с рождения
Признаки денервации при ЭМГ исследовании, II тип ЭМГ
I тип ЭМГ со снижением амплитуды
I тип ЭМГ со снижением амплитуды
Медленно прогрессирующий характер
Непрогрессирующий или медленно прогрессирующий характер
Постепенная положительная динамика с улучшением двигательных функций
Спорадический и аутосомно-рецессивный
Наследственность не отягощена
Лечение
Тактика лечения
Цели лечения:
1. Коррекция двигательных нарушений.
2. Обеспечить больному социальную адаптацию.
3. Определить форму спинальной амиотрофии и обеспечить адекватное лечение.
Немедикаментозное лечение:
2. Лечебная физкультура.
4. Ортопедическая коррекция.
Медикаментозное лечение
— никотинамид 10-20 мг/сут.;
Общеукрепляющая терапия: витамины группы В, фолиевая кислота, препараты магния.
Аминокислоты: церебролизин, метионин, глутаминовая кислота.
Препараты, влияющие на тканевой метаболизм: рибоксин, карнитин, коэнзим Q.
Препараты, улучшающие периферическое кровообращение: трентал, теоникол.
Дальнейшее ведение: диспансерный учет у невропатолога по месту жительства. Регулярно занятия ЛФК, проводить курсы поддерживающей терапии через каждые 3-4-6 месяца.
Основные медикаменты:
2. Актовегин ампулы по 2 мл 80 мг
3. Винпоцетин (кавинтон), таблетки 5 мг
4. Пиридоксина гидрохлорид ампулы по 1 мл 5%
5. Прозерин ампулы по 1 мл 0,05%
6. Фолиевая кислота, таблетки 0,001
7. Церебролизин ампулы по 1 мл
8. Цианокобаламин, ампулы по 200 и 500 мкг
Дополнительные медикаменты:
1. Гинкго-Билоба, (танакан) таблетки 40 мг
2. Глицин, таблетки 0,1
3. Дибазол, таблетки 0,02
4. Карнитин хлорид, 20% 100 мл во флаконах
6. Метионин, таблетки 0,25
7. Нейромидин, таблетки 20 мг
8. Нейромультивит, таблетки
9. Неуробекс, таблетки
10. Никотинамид, таблетки 0,025, ампулы 2,5% 1 мл
11. Пирацетам, ампулы 5 мл 20%
12. Пирацетам, таблетки 0,2
13. Рибоксин, таблетки 0,2
14. Сермион, ампулы и таблетки 5 мг, 10 мг
15. Тиамина хлорид, ампулы 1 мл 5%
16. Цитохром С, 025% 4 мл во флаконе, таблетки 10 мг
Индикаторы эффективности лечения:
1. Стабилизация патологического процесса.
2. Повышение мышечного тонуса.
3. Увеличение двигательной активности.
Госпитализация
Показания к госпитализации (плановая): прогрессирующая мышечная слабость, атрофии мышц, дрожание конечностей, ограничение активных движений, мышечная гипотония, отставание в моторном развитии.
Профилактика
Профилактические мероприятия: полноценное белковое питание с ограничением углеводов, жиров; отдых, профилактика инфекций, контрактур.
Информация
Источники и литература
Информация
Список разработчиков:
Разработчик
Место работы
Должность
Мухамбетова Гульнара Амерзаевна
КазНМУ, кафедра нервных болезней
Ассистент, кандидат медицинских наук
Кадыржанова Галия Баекеновна
РДКБ «Аксай», психоневрологическое отделение №3
Серова Татьяна Константиновна
РДКБ «Аксай», психоневрологическое отделение №1
Балбаева Айым Сергазиевна
РДКБ «Аксай», психоневрологическое отделение №3
Глава 1. : «Синдром Персонейджа-Тернера»

Глава 1. Синдром Персонейджа-Тернера
Синдром Персонейджа—Тернера (СПТ; синонимы: невралгическая плечевая амиотрофия, идиопатический брахиальный неврит, идиопатическая плечевая плексопатия) относится к числу редких неврологических заболеваний, связанных с поражением ПНС. Впервые данная патология была описана английскими врачами М. Parsonage и J. Turner в 1948 г. До настоящего времени нозологическая принадлежность заболевания окончательно не установлена. В литературе СПТ чаще рассматривается как локальная форма ВДП или как плечевая плексопатия неясного генеза [5, 7]. Клинические проявления СПТ — острая боль в надплечье и области плечевого сустава с последующим развитием атрофического пареза проксимальных отделов руки на фоне уменьшения интенсивности болевого синдрома. Для СПТ характерна односторонняя, реже двусторонняя локализация процесса с полной или парциальной клинической картиной.
Несмотря на ряд публикаций, посвященных данной патологии, остаются нерешенными некоторые вопросы этиологии, патогенеза, топического уровня поражения и выбора дифференцированного лечения.
Мы наблюдали 30 больных (26 мужчин, 4 женщины) в возрасте 16—57 лет с диагнозом СПТ. На основании проведенных обследований установлено, что данному заболеванию более подвержены лица трудоспособного возраста (30—50 лет), преимущественно мужчины (соотношение мужчин и женщин составило 6,5:1). Поражение правой или левой верхней конечности наблюдалось примерно с одинаковой частотой (46,7% и 43,3%), у 3 больных (10%) имела место двусторонняя локализация процесса. В большинстве случаев (53,3%) заболевание развилось без видимой причины. 36,7% больных накануне перенесли респираторную инфекцию или отмечали переохлаждение. Достаточно редко (10% случаев) клинические проявления СПТ развились остро после сна. У 17 больных (56,7%) наблюдалась классическая клиническая картина СПТ с острым началом. В 8 случаях (26,7%) имело место подострое течение заболевания с развитием парезов и атрофий в течение 1—3 месяцев на фоне нерезкого болевого синдрома. Хроническое течение у 3 больных (10%) характеризовалось медленным прогрессированием атрофического пареза руки на протяжении 6 месяцев — 2 лет. В 2 случаях (6,7%) наблюдалась острая безболевая форма СПТ. У 3 пациентов (10%) отмечалось альтернирующее течение заболевания с рецидивами на контрлатеральной стороне через 2 месяца — 9 лет. Выраженность пареза не коррелировала с длительностью заболевания и варьировала от легкой (23,3%) и умеренной (26,7%) до выраженной (40%) степени. В 10% случаев имело место абортивное течение СПТ с легкими амиотрофиями плечевого пояса при достаточной мышечной силе в руке. Атрофии чаще наблюдались в дельтовидной (60%), надостной и подостной мышцах (53,3%), передней зубчатой (46,7%), бицепсе (36,7%), реже трицепсе (20%), большой грудной мышце (6,7%) и мышцах предплечья (3,3%). В единственном случае отмечались фасцикуляции в дельтовидной мышце и трицепсе. У подавляющего числа больных (73,3%) имелось одновременное поражение нескольких нервов плечевого сплетения и, как следствие, распространенные атрофии мышц плечевого пояса и проксимальных отделов руки. У 26,6% пациентов наблюдались парциальные формы СПТ с заинтересованностью только одного или двух нервов. В 10% случаев одновременно с клиническими проявлениями СПТ или на несколько дней раньше развивались острые мононевропатии другой локализации с вовлечением тройничного, языкоглоточного, малоберцового нервов, дистальных отделов срединного нерва на контрлатеральной стороне.
При лабораторных исследованиях крови и мочи патологических изменений выявлено не было. В СМЖ в 63,2% случаев обнаружена легкая белково-клеточная диссоциация с содержанием белка 0,41—0,60 г/л; в 10% незначительный лимфоцитарный цитоз до 66 • 106 клеток/л; в 36,8% случаев ликвор оставался неизмененным. Рентгенография шейного отдела позвоночника лишь у 2 больных выявила признаки остеохондроза 3—4-й степени. При МРТ спинного мозга, произведенной 8 пациентам, не было обнаружено компрессии невральных и сосудистых структур. МР-ангиография у 2 пациентов с острым течением СПТ не выявила дефицита кровотока в бассейне подключичных артерий. При проведении иммунологических тестов регистрировались разнонаправленные изменения клеточного и (или) гуморального иммунитета, не имевшие достоверных отличий. ЭНМГ в 84% случаев выявляла признаки поражения нервов плечевого сплетения, преимущественно подмышечного (44%), реже длинного грудного, срединного, лучевого нервов (по 16%), а также надлопаточного и мышечно-кожного нервов (по 4%). Данные ЭНМГ чаще указывали на смешанный (48%) или преимущественно демиелинизирующий (40%) характер обследованных нервов. Признаки аксонального повреждения нервов обнаружены только у 12% больных. В 16% случаев результаты ЭНМГ свидетельствовали о заинтересованности корешковых структур.
В исследуемой группе всем пациентам проводилась комплексная терапия, включающая сосудорегулирующие препараты, анальгетики, физиотерапевтические процедуры, лечебную физкультуру. У 23 больных (76,7%) использовались глюкокортикостероиды в дозе 40—60 мг/сут по альтернирующей схеме до достижения терапевтического эффекта. На фоне лечения полное выздоровление наблюдалось у 3 больных (10%). Хороший эффект в виде купирования болевого синдрома и уменьшения степени пареза на 2 балла отмечен в 9 случаях (30%); удовлетворительный эффект с уменьшением боли и увеличением силы в руке на 1 балл — в 11 случаях (36,7%). Отсутствие эффекта или незначительное улучшение имело место у 7 больных (23,3%). Существенного влияния глюкокортикоидов на течение и прогноз заболевания выявлено не было. Менее выраженный эффект от проводимой терапии наблюдался у больных с хроническим течением СПТ и предполагаемым участием в развитии заболевания сосудистых факторов. Однако плохое восстановление отмечалось и в отдельных случаях острых форм СПТ.
В качестве иллюстрации характерной клинической картины заболевания приводим наблюдение.
Больной С., 42 лет, не работающий, поступил в неврологическое отделение с жалобами на ноющие боли в области правого плечевого сустава и правой лопатки, слабость в проксимальных отделах правой руки. Заболел остро 3 недели назад, когда без видимой причины появились интенсивные боли в правом плечевом суставе. Через неделю на фоне постепенного уменьшения болевого синдрома присоединилась слабость в руке. Амбулаторно лечения не получал. Госпитализирован планово. Из перенесенных заболеваний отмечал дискогенную радикулоишемию Ly-Si справа с парезом стопы, язвенную болезнь 12-перстной кишки. Ранее злоупотреблял алкоголем. При поступлении общее состояние удовлетворительное. АД 130/80 мм рт. ст. Соматически компенсирован. В неврологическом статусе: со стороны черепных нервов патологии не выявлено. Объем активных и пассивных движений в конечностях полный. Симптом «крыловидной» лопатки справа, гипотрофия правой дельтовидной мышцы. Снижена сила в проксимальных отделах правой руки до 4 баллов, в дистальных отделах рук сила достаточная. Тонус мышц верхних конечностей не изменен. Парез разгибателей правой стопы 3-3,5 балла, гипотония и легкая гипотрофия мышц правой голени. Сухожильно-периостальные рефлексы на руках и коленные средней живости без разницы сторон; ахиллов рефлекс слева снижен, справа не вызывается. Брюшные рефлексы живые, подошвенный справа снижен. Чувствительных нарушений не выявлено.
При обследовании: общеклинические, биохимические анализы крови в норме. Рентгенография пояснично-крестцового отдела позвоночника: сглажен поясничный лордоз, остеохондроз дисков Ly-Si 2-й степени, спондилоартроз Lm-Ljy, задние остеофиты Lrv, Ly. При ЭНМГ обнаружена патология со стороны правого подмышечного нерва смешанного характера. МРТ шейного отдела: костно-травматических изменений не выявлено, выпрямлен шейный лордоз, субхондрально-дегенеративные изменения, краевые костные разрастания тел позвонков, правосторонняя парамедианная грыжа межпозвонковых дисков Су—Су] 5 мм, дорсальные выпячивания дисков Сц—Су до 2—3 мм без признаков компрессии спинного мозга и невральных структур; сагиттальный размер позвоночного канала на уровне Су до 11 мм. МР-ангиография: просвет подключичных артерий не изменен, признаков стеноза не обнаружено (рис. 4).
Рис. 4. МР-ангиография больного С. с диагнозом «СПТ справа»: признаков стеноза подключичной артерии не выявлено (показано стрелками)
Таким образом, у больного имело место острое развитие проксимального пареза руки с атрофиями передней зубчатой и дельтовидной мышц на фоне предшествующего выраженного болевого синдрома, что соответствует характерной клинической картине и стадийности СПТ. Сенсо-арефлекторная полиневропатия в ногах, вероятно, носила токсический (алкогольный) характер. Результаты ЭНМГ подтвердили поражение подмышечного нерва. МР-ангиография не выявила дефицита кровотока в бассейне подключичной артерии, однако наличие парамедианной грыжи диска Cy—Cvi не исключало компрессию радикуло-медуллярной артерии. Учитывая возможное участие сосудистых факторов в развитии СПТ у данного больного, а также противопоказания для использования глюкокортикостероидов (язвенная болезнь в анамнезе), проводилась терапия сосудорегулирующими препаратами, витаминами В! и В)2, ГБО. После купирования болевого синдрома был назначен массаж, электростимуляция дельтовидной мышцы. Через 3 недели пребывания в стационаре сила в проксимальных отделах руки восстановилась до 5 баллов. Больной был выписан с полным клиническим выздоровлением.
Полученные результаты в целом соответствуют литературным данным о том, что при СПТ преобладает молодой и средний возраст, отмечается заметное преобладание мужчин, имеет место характерная клиническая картина и стадийность развития заболевания [1, 5]. Не выявлена преимущественно правосторонняя локализация процесса, как указывают ряд авторов [1, 2, 5]. Не все исследователи выделяют подострые и хронические варианты СПТ, которые имели место в наших наблюдениях.
Разногласия авторов касаются в основном вопросов этиологии, патогенеза, топического уровня поражения нервной системы при СПТ. Согласно данным литературы, провоцирующими факторами развития СПТ могут быть перенесенные накануне инфекции (цитомегаловирусные, энтеровирусные), вакцинации, введение сывороток, применение стрептокиназы, героиновая интоксикация [5, 8, 13]. Описаны клинические случаи невралгической плечевой амиотрофии, развившейся после родов, травм, операций с общим наркозом [11, 14]. Примерно в половине случаев этиологический фактор выявить не удается, что отмечено и нами. В литературе преобладает мнение об аутоиммунных механизмах развития СПТ как локальной формы аутоиммунных полиневропатий [1—6, 12]. В подтверждение этой точки зрения описаны случаи невралгической плечевой амиотрофии с вовлечением добавочного, диафрагмального, лицевого нервов [1, 7, 13, 14]. В то же время ряд авторов полагают, что в основе патогенеза заболевания лежит сосудистый фактор вследствие стеноза, тромбоза или сдавления подключичной и радикуломедуллярных артерий, кровоснабжающих плечевое сплетение и спинной мозг [2, 5]. Описана наследственная форма СПТ с аутосомно-доминантным типом наследования [9].
В наших наблюдениях аутоиммунные механизмы развития заболевания можно было предположить в 40% случаев. У 10% пациентов имели место сердечно-сосудистая патология и (или) выраженные дегенеративно-дистрофические изменения в позвоночнике, которые могли обусловить сосудистый фактор в развитии СПТ. Анализ характера распространения парезов и мышечных атрофий, а также результатов ЭНМГ показал, что при СПТ чаще поражаются подмышечный, надлопаточный, длинный грудной и мышечно-кожный нервы, что позволяет предположить локализацию процесса на уровне верхнего первичного пучка плечевого сплетения и отходящих от него периферических нервов. Мы допускаем и более высокое поражение при СПТ в месте соединения спинномозговых корешков С5 и С^ в пучок в так называемой точке Эрба, которая проецируется на 1 см кнаружи от края грудиноключично-сосцевидной мышцы в надключичной ямке. Подобная точка зрения на локализацию процесса при СПТ доминирует в русскоязычной и иностранной литературе в последние несколько лет [1, 6—8]. Этими же авторами высказывается мнение о преимущественно аксональном характере поражения периферических нервов. В наших исследованиях при ЭНМГ чаще выявлялись изменения нервов плечевого сплетения смешанного и демиелинизирующего характера. Наблюдения за больными не обнаружили достоверного влияния глюкокортикостероидов на течение и прогноз СПТ, что также встречается в литературе [1], однако в ряде случаев при доказанном аутоиммунном генезе заболевания назначение этих препаратов может быть оправдано.
Дифференциальный диагноз СПТ проводят с вертеброгенной цервикальной радикулопатией, травматической или компрессионно-ишемической плексопатией.
Таким образом, результаты проведенных исследований указывают на полифакторную природу СПТ с преобладанием аутоиммунных механизмов в патогенезе заболевания, а также подтверждают локализацию процесса на уровне первичного верхнего пучка и нервов плечевого сплетения или в месте соединения корешков С5 и Сб в сплетение. Нозологическая принадлежность СПТ окончательно не определена. Вероятно, данная патология является локальной формой демиелинизирующего процесса с преимущественным поражением плечевого сплетения.
Синдром Персонейджа-Тернера
Клиническая анатомия
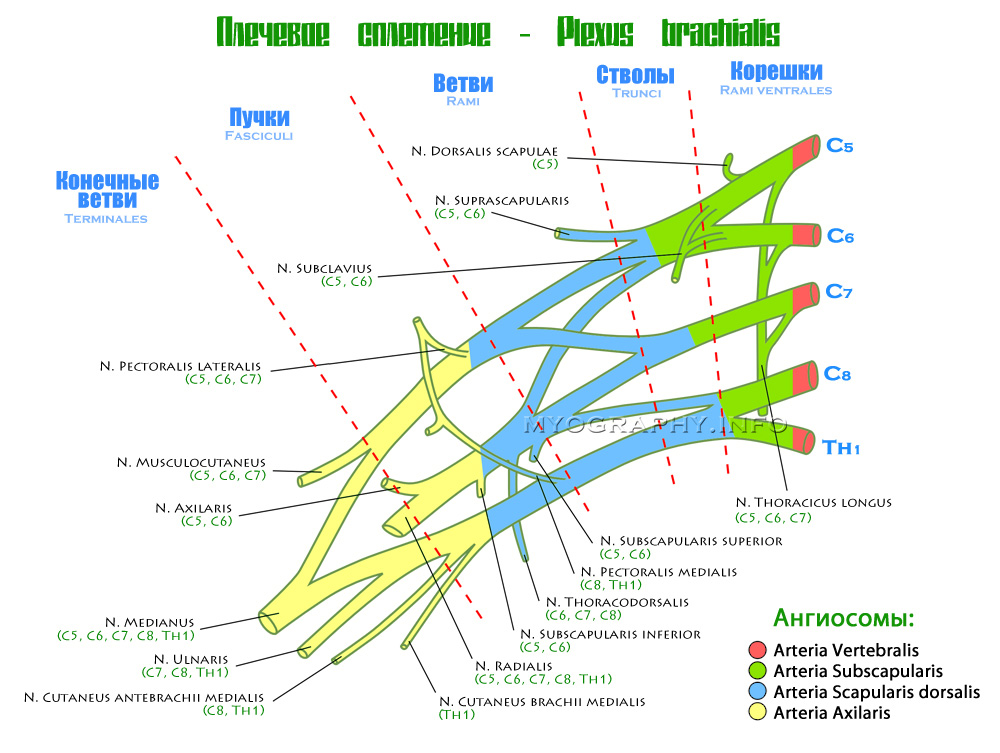
Плечевое сплетение – это сеть нервных волокон, сформированных вентральными ветвями четырех шейных и первого грудного спинномозговых нервов (C5-C8 и T1). Данное образование проходит через шейно-подмышечный канал над первым ребром и далее переходит в подмышечную ямку. Плечевое сплетение иннервирует верхнюю конечность (плечо, предплечье и кисть), а также некоторые мышцы шеи и плечевого пояса.
Эпидемиология/Этиология
Распространенность невралгической амиотрофии составляет примерно 2-3 случая на 100 000 человек в год. Чаще она встречается у мужчин (в среднем соотношение 3:2) в возрасте 30-70 лет. Данные о том, что превалируют случаи заболевания доминантной руки, отсутствуют. Как отсутствуют данные о большей распространенности заболевания какой-то одной руки (левой или правой). Этиология заболевания пока остается невыясненной. Болезнь описывается в самых разных клинических ситуациях, в том числе после травмы, перенесенного инфекционного заболевания, операции и вакцинации.
Клиническая картина
В самом начале заболевания возникает внезапная, постоянная и сильная боль в плечевом поясе. Боль может отдавать в область трапециевидной мышцы, плеча, предплечья или кисти. Боль обычно разлитая, усиливается ночью и может служить причиной ночных пробуждений. Боль описывается как очень сильная, ноющая, пульсирующая, иррадиирущая из плеча дистально вниз или проксимально вверх, в область шеи. Обычно боль проходит сама по себе и длится 1-2 недели, хотя в некоторых случаях может продолжаться и дольше.
К другим симптомам относятся:
Если в патологический процесс вовлекается длинный грудной нерв, то у пациента может обнаружиться «крыловидная лопатка», т.к. указанный нерв иннервирует переднюю зубчатую мышцу. Слабость также может быть связана с работой мышц, которые иннервируются периферическим нервом, комбинацией периферических нервов или плечевым сплетением. На электромиограмме видна обширная денервация поврежденных мышц. МРТ может показать неспецифическое воспаление в плечевом сплетении.
Дифференциальный диагноз
Вначале боль локализуется в области плечевого пояса. Она может маскироваться под множество других проблем с плечом, включая следующие:
Может обнаружиться слабость дистальных мышц, что также может встречаться при следующих состояниях:
Дифференциальный диагноз при МРТ:
Диагностика
Характерный паттерн боли и сменяющая эту боль сильнейшая слабость – вот основные признаки, по которым можно распознать синдром Персонейджа-Тернера. Подтвердить догадку возможно с помощью электромиографии. Исследования мышц верхней конечности с помощью электромиографии должны проводиться с особой тщательностью. Мышцы, которые не обследуются миографом в плановом порядке, должны быть исследованы с помощью иглы-электрода, даже если со стороны они кажутся полностью здоровыми. Синдром Персонейджа-Тернера относится к аксональным повреждениям, при котором чаще всего поражаются проксимальные мышцы верхней конечности. По этой причине при обследовании дистальных мышц верхней конечности показатели дистальной латентности, а также скорость проведения импульсов чувствительными и двигательными нервами обычно бывают в норме.
Критерии оценки эффективности
• Мануальное мышечное тестирование.
• Индекс боли в плече и инвалидизации (SPADI).
• DASH — ограничения функций плеча, предплечья и кисти руки.
• Оценочный опросник (Shoulder rating questionnaire — SRQ).
• Тест с колышками и девятью отверстиями.
Обследование
Клинический осмотр для подтверждения паралича длинного сгибателя большого пальца и глубокого сгибателя пальцев, слабости указательного пальца. Врачам следует обязательно проводить физикальное обследование мышц для того, чтобы обнаружить мышечную слабость у пациентов с СПТ.
Синдром Персонейджа-Тернера влияет на:
Лечение
Согласно последним обзорам, лечение СПТ начинают с пульс-терапии Преднизолоном. Это позволяет снизить болевой синдром и выраженность атрофических изменений в перспективе. В тех случаях, когда Преднизолон не эффективен, как правило, есть дополнительный факторы, которые решаются хирургически. С момента купирования болевого синдрома выполняют чрескожную электрическую стимуляцию (это также позволяет уменьшить атрофические изменения). В случае, если имеется патология в шейном отделе позвоночника, можно использовать эпидуральную анестезию – она может помочь отличить шейную радикулопатию от синдрома Персонейджа-Тернера. При опоясывающем лишае могут быть полезны антивирусные препараты.
Физическая терапия
В дополнении к медикаментозной терапии пациентам может быть назначена физическая терапия. Во время физической терапии специалистам следует сфокусироваться на обучении пациента, увеличении объема движений в верхней конечности, укрепляющих упражнениях для поддержания движения в области лопаток и техниках, способствующих снижению боли. Физическая терапия играет большую роль в лечении СПТ. Техники типа TENS (чрескожная электронейростимуляция) могут помочь снизить боль.
Продолжительность и интенсивность силовых упражнений зависят от степени мышечной денерваци, слабости мышц и уровня нарушения биомеханики. Также важен преморбидный функциональный уровень активности пациента. Упражнения на увеличение объема движения играют большую роль в терапии и должны подбираться с учетом того, какие мышцы оказались поражены. При выполнении этих упражнений может потребоваться помощь физического терапевта или эрготерапевта.
По понятным причинам, силовые упражнения не показаны при полной денервации мышц. Из-за отсутствия иннервации невозможны произвольные движения, поэтому выполнить упражнения с сопротивлением невозможно. Если денервация лишь частичная, то врач может назначить упражнения на укрепление ротаторной манжеты, стабилизаторов лопатки и других мышц верхней конечности. Выбор упражнений зависит от того, какой нерв или какая часть плечевого сплетения поражены. Упражнения с сопротивлением должны подбираться в соответствии со способностью мышц к нагрузке и уровнем боли.
Роль электрической стимуляции остается по-прежнему спорной, однако ее точно следует включать в терапию при продолжительной денервации, т.е. когда она длится уже больше четырех месяцев. Электрическая стимуляция может помочь в сохранении и восстановлении нормальных свойств денервированных мышц (если выбран подходящий режим стимуляции). Оптимальное начало электрической стимуляции – сразу же после повреждения мышечного нерва: чем дольше период между повреждением и лечением, тем меньше степень восстановления. Электрическая стимуляция не будет препятствовать регенерации аксона или реиннервации мышцы. Также она может указать на увеличение мышечной массы и сообщить о ее качестве.