история расшифровки генетического кода
История расшифровки генетического кода
• День когда написана моя судьба смотреть онлайн турецкий сериал на русском еще здесь.
Доктор физико-математических наук М. Д. Франк-Каменецкий
Химия и Жизнь №5, 1980 г., с. 34-41
Какие бы захватывающие дух открытия ни были сделаны в будущие двадцать лет, выяснение механизма биосинтеза белка и расшифровка генетического кода останутся главными событиями в биологии XX века.
Как только в 1953 г. появилась знаменитая двойная спираль Уотсона и Крика и стало ясно, что наследственная информация записана в виде последовательности нуклеотидов ДНК, сразу же возник вопрос: как эта запись прочитывается и используется в клетке? Ясной постановкой проблемы и привлечением к ней широкого внимания наука обязана Георгию Гамову. Этот выдающийся физик впервые сформулировал в 1954 году проблему генетического кода. Предстояло понять, как ДНК-овая последовательность, состоящая из четырех сортов нуклеотидов, переводится в белковую последовательность, состоящую из 20 сортов аминокислотных остатков. Гамов предложил вариант словаря, переводящего тексты с четырехбуквенного языка ДНК на двадцати-буквенный язык белка. Это был первый, пока чисто умозрительный, вариант генетического кода.
Естественно, сам биосинтез белка идет с участием многочисленных белков-ферментов. Прежде всего, с помощью фермента, называемого РНК-полимеразой, с какого-то отрезка ДНК снимается копия в виде молекулы РНК. На участке, с которого снята копия, записаны сведения о строении одного белка. Этот участок и называют геном. РНК-овая копия гена получила название матричной РНК (ее сокращенно обозначают мРНК, чтобы не путать с некоторыми другими РНК, также участвующими в биосинтезе белка). Последовательность нуклеотидов в мРНК идентична последовательности нуклеотидов в скопированном участке ДНК, то есть это точный отпечаток гена.
РНК-овый текст также состоит из четырех букв. Именно по нему и синтезируется белок. Происходит это в чрезвычайно сложно устроенном агрегате, включающем десятки различных белковых молекул и называемом рибосомой. Рибосома, кроме белка, состоит также из специальных, рибосомальных РНК (рРНК). Химическая структура этих РНК в принципе такая же, как у мРНК. Однако у них нуклеотиды расположены совсем в другом порядке. Конечно, эти рРНК также копируются с ДНК, то есть в ДНК есть специальные гены рибосомальных РНК. Так что гену вовсе не обязательно должен соответствовать какой-то белок.
Рибосома пропускает через себя нить мРНК, читает текст, записанный в виде последовательности нуклеотидов на этой нити, и синтезирует соответствующую белковую, то есть аминокислотную, последовательность. Таким образом, именно на рибосоме язык нуклеиновых кислот (ДНК и РНК) переводится на язык аминокислотной последовательности белков.
Итак, в клетке существует очень сложный механизм биосинтеза белка, реализующий генетический код. Но каков же сам код?
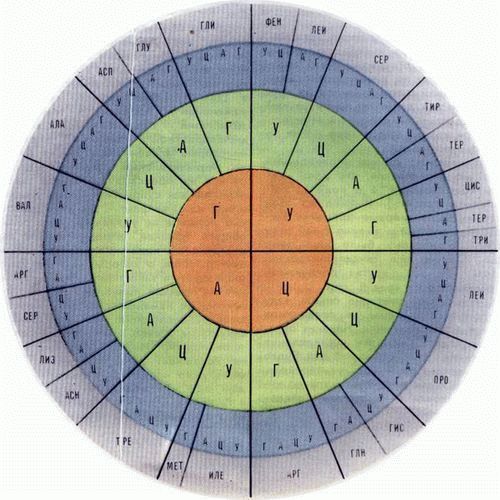
На рубеже 50-х и 60-х годов Фрэнсис Крик и его сотрудники выяснили основные свойства кода. Было доказано, что код триплетный, то есть одной аминокислоте соответствует последовательность из трех нуклеотидов на мРНК. Эта тройка нуклеотидов была названа кодоном. Было показано, что текст, записанный в мРНК, считывается рибосомой последовательно, кодон за кодоном, начиная с некоторого начального, инициирующего кодона, по следующей схеме:
КАК РАСШИФРОВАЛИ КОД
Представьте себе, что вместо Розеттского камня, на котором один и тот же текст был написан египетскими иероглифами и по-гречески, откопали бы во время наполеоновского похода в Египет живого древнего египтянина. Тогда не потребовался бы гений Шампольона, чтобы составить французско-древнеегипетский словарь. Достаточно было бы показывать египтянину различные предметы, а он рисовал бы соответствующие иероглифы.
Ниренберг и Маттеи получили экстракт из кишечной палочки и добавили к нему гомополимер, состоящий только из урацилов. Так бесклеточной системе был задан первый вопрос: какой аминокислоте соответствует кодон УУУ? Ответ был однозначен: кодону УУУ отвечает фенилаланин. Этот ответ произвел настоящую сенсацию. Путь к расшифровке кода был открыт!
Очень быстро удалось сделать подобный перевод для многих аминокислот. Однако определять последовательность нуклеотидов в искусственных кодонах было довольно трудно. В то время еще не умели синтезировать даже короткие фрагменты с заданной последовательностью. Умели лишь получать полинуклеотиды со случайной последовательностью из смеси мономеров, да и то не из любой смеси. Начали думать, как попытаться иными способами расшифровывать кодоны. Но неожиданно произошел новый прорыв, и ситуация резко изменилась.
Мы видели, что у истоков проблемы кода стоял физик, общие свойства кода были выяснены генетическими методами, после чего за дело взялись биохимики. Окончательно проблема была решена, когда на помощь биохимикам пришли химики-синтетики.
Для Кораны эта работа была первым шагом на долгом пути, приведшем в конечном счете к синтезу гена. Теперь его методы, значительно продвинутые вперед усилиями многих химиков, очень широко используются для получения искусственных генов в генной инженерии. Наиболее впечатляющим успехом на этом пути стал синтез гена инсулина человека. Этот ген содержит около 200 нуклеотидов, расположенных в строго заданной последовательности. Но пятнадцать лет назад об этом никто не мог и мечтать.
Сенсацией тех лет, быстро завершившейся полной расшифровкой кода, был синтез ди- и тринуклеотидов. Из таких двоек и троек биохимическими методами, с помощью ферментов, синтезировали длинные полинуклеотиды, в которых эти двойки или тройки повторялись много-много раз. Затем полинуклеотиды со строго определенной и известной последовательностью добавляли в бесклеточную систему и определяли их соответствие белковым цепям.
ОСНОВНАЯ ЗАКОНОМЕРНОСТЬ КОДА
Эта главная особенность кода была замечена еще на самой ранней стадии его расшифровки. Конечно, дублетами нельзя закодировать все двадцать аминокислот, так как различных дублетов может быть всего 4 2 = 16. Поэтому третий нуклеотид в кодоне должен нести некоторую смысловую нагрузку.
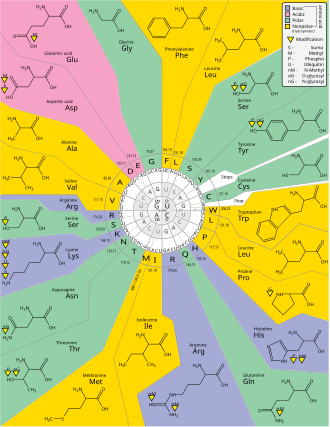
Рис. 1. Генетический код
Рис. 2. Пиримидиновый класс
Рис. 3. Пуриновый класс
УНИВЕРСАЛЕН ЛИ КОД?
Но позвольте, вправе спросить читатель, ведь бесклеточная система получена из конкретного организма. Где гарантия, что опыты по расшифровке кода в бесклеточной системе, взятой из другого организма, дадут тот же результат? Вопрос совершенно резонный. И естественно, он возник уже в ходе работ по расшифровке кода.
Первоначально авторы исследований аккуратно оговаривали, что речь идет не о коде вообще, а о коде Е. coli (кишечной палочки). Именно из этой бактерии была впервые получена бесклеточная система и именно с ней вели работы, о которых было рассказано выше. Однако все свидетельствовало о том, что код других организмов не отличается от кода Е. coli.
Правда, были получены мутанты кишечной палочки с некоторыми отклонениями в коде: отдельные терминирующие кодоны читались в них как значащие, то есть отвечали определенным аминокислотам. Такое явление было названо супрессией.
К счастью, природа припасла для молекулярных биологов сюрприз. Оказалось, что существуют специальные ферменты, рестриктазы, которые аккуратно разрезают молекулы ДНК в строго определенных местах (то есть там, где есть определенная последовательность нуклеотидов).
Открытие в начале 70-х годов рестриктаз, а также применение гель-электрофореза для разделения полученных фрагментов ДНК дало возможность чрезвычайно эффективно читать последовательности ДНК. Если до 1977 года было определено лишь небольшое число сравнительно коротких последовательностей, то начиная с 1977 г. расшифрованные последовательности посыпались как из рога изобилия. И вот тут-то код, лежавший без дела целых десять лет, заработал вовсю. Наконец представилась возможность напрямую сравнить между собой естественные нуклеиновые и белковые тексты и окончательно проверить, действительно ли код таков, каким его привыкли считать.
Хотя эра расшифровки нуклеиновых последовательностей началась совсем недавно, она уже принесла поразительные открытия. Были опровергнуты, казалось бы, самые твердо установленные представления о гене как о непрерывном участке ДНК, отвечающем одному белку. К всеобщему изумлению оказалось, что на одном участке ДНК может быть записана информация сразу о двух и даже о трех белках (см. «Химию и жизнь», 1977, № 4). И уж совсем трудно передать словами чувства, испытанные генетиками, когда оказалось, что у высших организмов гены расчленены, то есть как бы нарезаны на куски, а между кусками расположены последовательности, которые вообще непонятно зачем нужны («Химия и жизнь», 1978, № 11). Итак, под натиском первых же фактов, ознаменовавших эру расшифровки нуклеиновых последовательностей, само понятие гена потеряло универсальность, а код выстоял. Его универсальность казалась окончательно установленной.
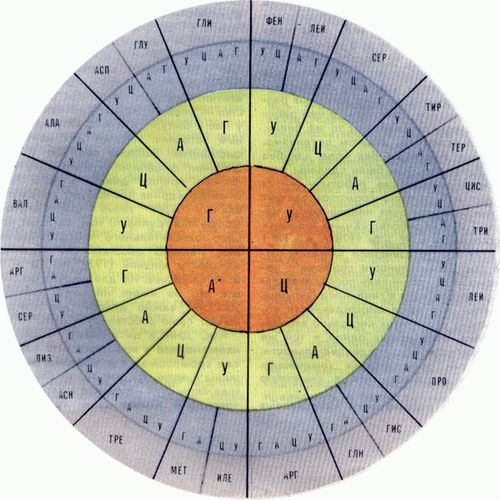
Но не тут-то было. В 1979 г. выяснилось, что у митохондрий код другой.
Рис. 4. Код митохондрий
Постойте, но ведь именно так должен выглядеть «идеальный» код! Тот самый код, который предсказывал Ичас еще в 1969 г.
Словом, неуниверсальность кода может оказаться исключением, которое подтверждает общее правило, а может предвещать и более важные открытия.
Эволюция генетического кода
Эволюция генетического кода
Рисунок с обложки журнала PNAS со статьей о механизме возникновения альтернативного генетического кода, объясняющей различия митохондриального генетического кода иглокожих перистых звезд и пчёл. Автор рисунка: Michael Plenikowski (University of Mainz, Mainz, Germany).
Автор
Редакторы
Генетический код — это «алфавит», лежащий в основе функционирования любой живой системы на Земле. Ранее считавшийся неизменным и универсальным для всех организмов, генетический код, на самом деле, подвержен эволюционному процессу, в результате которого могут возникать различные аномалии — например, варианты кода, специфичные для отдельных биологических видов или даже субклеточных органелл (митохондрий). Одна из таких аномалий, по-видимому, представляет собой древнюю адаптацию, защищающую от окислительного стресса, вызванного переходом к аэробному дыханию, и приводящую к высокой концентрации метионина в митохондриях.
Люди и многие другие животные используют два генетических кода для трансляции наследственной информации — стандартный код для белков, закодированных в клеточном ядре, и более «современный» вариант кода для трансляции митохондриального генома. Несмотря на первостепенное значение генетического кода в биологии, причины существования альтернативного кода в митохондриях оставались загадочными с момента его открытия в 1979 году. Различные гипотезы, касающиеся причин возникновения изменений в генетическом коде, отдавали предпочтение нейтральным эволюционным механизмам, поскольку принцип кодирования аминокислот не должен был меняться. Считалось, что любое изменение «смысла» отдельного кодона приведет к ошибкам в каждом транслируемом белке, что не может не иметь пагубных последствий для клетки. Адаптивное преимущество подобных изменений ставилось под сомнение. Согласно гипотезе «захвата кодона», GC-богатые кодоны могут исчезать из генома в результате изменения общего содержания нуклеотидных остатков G и C. (Известно, что геномы различных организмов могут существенно отличатся по этому параметру: сравните, например, АТ-богатый (75%) геном Micoplasma capricolum и GC-богатый (74%) геном Micrococcus luteus.) Как только кодон исчезает из генома организма, он теоретически может появиться снова в результате дрейфа генов. Такой кодон может быть «захвачен» путём неверного прочтения какой-нибудь тРНК из другой семьи кодонов. Таким образом, перекодировка кодона происходит абсолютно нейтрально и без появления «нездоровых» белков.
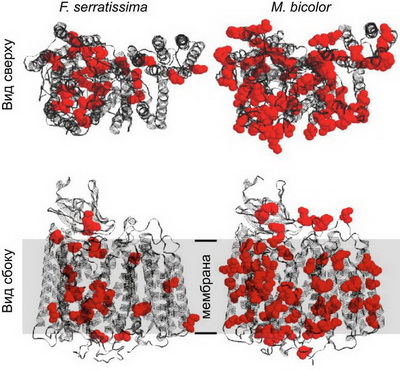
Рисунок 1. Структурные модели белков электронтранспортной цепи (комплекса цитохромоксидазы COX), кодируемых геномом митохондрий перистой морской звезды (иглокожее Florometra serratissima) и пчелы (Melipona bicolor). Вид сверху соответствует виду из митохондриального внутримембранного пространства, вид сбоку — те же структуры, внутримембранное пространство сверху. Остатки метионина отмечены красным.
Вопреки гипотезе «захвата кодона», гипотеза «двусмысленного прочтения» предлагает механизм, не являющийся нейтральным. Согласно этой гипотезе, мутации в тРНК приводят к тому, что считывание кодона осуществляется двумя различными тРНК — обычной и мутантной, — «заряженными» различными аминокислотами, но узнающими один и тот же кодон. Такая двусмысленность в прочтении кодона является критическим начальным этапом в процессе последовательного перекодирования кодона. Затем мутантная тРНК постепенно займёт место обычной, которая будет утеряна в результате случайных мутаций. Изменение GC-содержания не играет при таком сценарии определяющей роли, и весь процесс определяется полезностью изменений на уровне синтезируемых белков, другими словами — появлением или отсутствием адаптаций.
В статье, опубликованной группой исследователей из Университета Иоганна Гутенберга в Майнце, впервые показано, что причиной переопределения кодона AUA с кодирующего изолейцин на кодирующий метионин (что и наблюдается в митохондриях многих организмов) являются значительные и благоприятные в эволюционном плане изменения на уровне кодируемых белков.
Митохондрии — это «энергетические станции» клеток, перерабатывающие химическую энергию, выделяемую при окислении питательных веществ, и запасающие её в виде энергии ковалентных связей в молекуле аденозинтрифосфата (АТФ). Электрон-транспортная цепь, представляющая собой набор белков-ферментов, расположенных во внутренней мембране митохондрий, является ключевым узлом, производящим АТФ. Несмотря на то, что этот узел является жизненно важным, в качестве побочных продуктов он производит активные формы кислорода (сокращённо АФК), способные инициировать распространение свободных радикалов, повреждающих клетку, вызывающих болезни и, возможно, являющихся одной из причин старения. Поэтому митохондрии выработали различные механизмы защиты, препятствующие появлению АФК и распространению свободных радикалов.
Авторы статьи убедительно продемонстрировали, что переопределение кодона (с изолейцина на метионин) в митохондриях организмов, активно использующих аэробное дыхание (например, пчёл, но не «мало дышащих» иглокожих), привело к значительному накоплению легко окисляемых аминокислотных остатков метионина в белках, находящихся в богатой окислителями внутренней мембране митохондрий. Этот видимый парадокс легко разрешается, если принять во внимание антиокислительные свойства метионина. В своей работе учёные представили экспериментальные доказательства того, что присутствие метионина в качестве антиоксиданта во внутренней мембране создаёт дополнительный барьер для разрушительного влияния АФК. Метионин является природным, отобранным в процессе эволюции, антиоксидантом, необходимым для функционирования электрон-транспортной цепи митохондрий и защищающий их от окислительного стресса.
Таким образом, коллективное изменение последовательностей белков в результате переопределения кодона может предоставлять преимущество в процессе естественного отбора, что подтверждает гипотезу «двусмысленного кодирования», объясняющую эволюцию генетического кода. Другими словами, окислительный стресс сформировал митохондриальный генетический код.
СОДЕРЖАНИЕ
История
Кодоны
Последующая работа Хар Гобинд Хорана определила остальную часть генетического кода. Вскоре после этого Роберт У. Холли определил структуру транспортной РНК (тРНК), адапторной молекулы, которая облегчает процесс трансляции РНК в белок. Эта работа была основана на более ранних исследованиях Очоа, которые принесли последнему Нобелевскую премию по физиологии и медицине в 1959 году за работу по энзимологии синтеза РНК.
Три стоп-кодона были названы первооткрывателями Ричардом Эпштейном и Чарльзом Стейнбергом. «Янтарь» был назван в честь их друга Харриса Бернстайна, фамилия которого в переводе с немецкого означает «янтарь». Два других стоп-кодона были названы «охра» и «опал», чтобы сохранить тему «названий цветов».
Расширенные генетические коды (синтетическая биология)
В широкой академической аудитории широко принята концепция эволюции генетического кода от исходного и неоднозначного генетического кода к четко определенному («замороженному») коду с репертуаром из 20 (+2) канонических аминокислот. Однако есть разные мнения, концепции, подходы и идеи, что лучше всего изменить экспериментально. Предлагаются даже модели, которые предсказывают «точки входа» для инвазии синтетических аминокислот в генетический код.
С 2001 года 40 неприродных аминокислот были добавлены в белок путем создания уникального кодона (перекодирования) и соответствующей пары трансфер-РНК: аминоацил-тРНК-синтетаза, чтобы кодировать его с различными физико-химическими и биологическими свойствами для использования в качестве инструмент для изучения структуры и функции белков или для создания новых или улучшенных белков.
Х. Мураками и М. Сисидо расширили некоторые кодоны до четырех и пяти оснований. Стивен А. Беннер сконструировал функциональный 65-й ( in vivo ) кодон.
В 2016 году был создан первый стабильный полусинтетический организм. Это была (одноклеточная) бактерия с двумя синтетическими основаниями (называемыми X и Y). Основания пережили деление клеток.
В 2017 году исследователи из Южной Кореи сообщили, что они создали мышь с расширенным генетическим кодом, которая может производить белки с неестественными аминокислотами.
Функции
Рамка для чтения
Старт и стоп кодоны
Эффект мутаций
Вырождение
Предвзятость использования кодонов
| Кодон | AA | Дробная часть | Freq ‰ | Число | Кодон | AA | Дробная часть | Freq ‰ | Число | Кодон | AA | Дробная часть | Freq ‰ | Число | Кодон | AA | Дробная часть | Freq ‰ | Число |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| UUU | F | 0,46 | 17,6 | 714 298 | УКУ | S | 0,19 | 15,2 | 618 711 | UAU | Y | 0,44 | 12.2 | 495 699 | UGU | C | 0,46 | 10,6 | 430 311 |
| UUC | F | 0,54 | 20,3 | 824 692 | UCC | S | 0,22 | 17,7 | 718 892 | ОАК | Y | 0,56 | 15.3 | 622 407 | UGC | C | 0,54 | 12,6 | 513 028 |
| UUA | L | 0,08 | 7,7 | 311 881 | УЦА | S | 0,15 | 12.2 | 496 448 | UAA | * | 0,30 | 1.0 | 40 285 | UGA | * | 0,47 | 1.6 | 63 237 |
| UUG | L | 0,13 | 12,9 | 525 688 | UCG | S | 0,05 | 4.4 | 179 419 | UAG | * | 0,24 | 0,8 | 32 109 | UGG | W | 1,00 | 13,2 | 535 595 |
| CUU | L | 0,13 | 13,2 | 536 515 | CCU | п | 0,29 | 17,5 | 713 233 | CAU | ЧАС | 0,42 | 10.9 | 441 711 | CGU | р | 0,08 | 4.5 | 184 609 |
| CUC | L | 0,20 | 19,6 | 796 638 | CCC | п | 0,32 | 19,8 | 804 620 | САС | ЧАС | 0,58 | 15.1 | 613 713 | CGC | р | 0,18 | 10,4 | 423 516 |
| CUA | L | 0,07 | 7.2 | 290 751 | CCA | п | 0,28 | 16,9 | 688 038 | CAA | Q | 0,27 | 12,3 | 501 911 | CGA | р | 0,11 | 6.2 | 250 760 |
| CUG | L | 0,40 | 39,6 | 1 611 801 | CCG | п | 0,11 | 6.9 | 281 570 | CAG | Q | 0,73 | 34,2 | 1,391,973 | CGG | р | 0,20 | 11,4 | 464 485 |
| AUU | я | 0,36 | 16.0 | 650 473 | ACU | Т | 0,25 | 13,1 | 533 609 | AAU | N | 0,47 | 17.0 | 689 701 | AGU | S | 0,15 | 12.1 | 493 429 |
| AUC | я | 0,47 | 20,8 | 846 466 | АКК | Т | 0,36 | 18,9 | 768 147 | AAC | N | 0,53 | 19,1 | 776 603 | AGC | S | 0,24 | 19,5 | 791 383 |
| AUA | я | 0,17 | 7,5 | 304 565 | ACA | Т | 0,28 | 15.1 | 614 523 | AAA | K | 0,43 | 24,4 | 993 621 | AGA | р | 0,21 | 12.2 | 494 682 |
| АВГУСТ | M | 1,00 | 22,0 | 896 005 | АЧГ | Т | 0,11 | 6.1 | 246 105 | AAG | K | 0,57 | 31,9 | 1,295,568 | AGG | р | 0,21 | 12.0 | 486 463 |
| ГУ | V | 0,18 | 11.0 | 448 607 | GCU | А | 0,27 | 18,4 | 750 096 | ГАУ | D | 0,46 | 21,8 | 885 429 | ГГУ | грамм | 0,16 | 10,8 | 437 126 |
| GUC | V | 0,24 | 14,5 | 588 138 | GCC | А | 0,40 | 27,7 | 1 127 679 | GAC | D | 0,54 | 25,1 | 1 020 595 | GGC | грамм | 0,34 | 22,2 | 903 565 |
| GUA | V | 0,12 | 7.1 | 287 712 | GCA | А | 0,23 | 15,8 | 643 471 | GAA | E | 0,42 | 29,0 | 1 177 632 | GGA | грамм | 0,25 | 16,5 | 669 873 |
| GUG | V | 0,46 | 28,1 | 1 143 534 | GCG | А | 0,11 | 7,4 | 299 495 | GAG | E | 0,58 | 39,6 | 1 609 975 | GGG | грамм | 0,25 | 16,5 | 669 768 |
Альтернативные генетические коды
Нестандартные аминокислоты
Вариации
Варианты генетических кодов, используемых организмом, могут быть выведены путем идентификации высококонсервативных генов, кодируемых в этом геноме, и сравнения использования его кодонов с аминокислотами в гомологичных белках других организмов. Например, программа FACIL выводит генетический код путем поиска, какие аминокислоты в доменах гомологичных белков чаще всего совпадают с каждым кодоном. Полученные вероятности аминокислот для каждого кодона отображаются в логотипе генетического кода, который также показывает поддержку стоп-кодона.
Источник
Гипотетический случайно возникший генетический код дополнительно мотивирует биохимическую или эволюционную модель его происхождения. Если бы аминокислоты были случайным образом отнесены к триплетным кодонам, было бы 1,5 × 10 84 возможных генетических кода. Это число определяется путем расчета количества способов, которыми 21 элемент (20 аминокислот плюс одна остановка) может быть помещен в 64 ячейки, при этом каждый элемент используется хотя бы один раз. Однако распределение кодонов в генетическом коде неслучайно. В частности, генетический код группирует определенные назначения аминокислот.
Аминокислоты, которые участвуют в одном и том же пути биосинтеза, обычно имеют одно и то же первое основание в своих кодонах. Это могло быть эволюционным реликтом раннего, более простого генетического кода с меньшим количеством аминокислот, который позже эволюционировал, чтобы кодировать больший набор аминокислот. Он также может отражать стерические и химические свойства, которые оказали другое влияние на кодон во время его эволюции. Аминокислоты со схожими физическими свойствами также имеют похожие кодоны, что снижает проблемы, вызванные точечными мутациями и ошибочными переводами.
Учитывая неслучайную схему генетического триплетного кодирования, разумная гипотеза происхождения генетического кода может касаться нескольких аспектов таблицы кодонов, таких как отсутствие кодонов для D-аминокислот, вторичные образцы кодонов для некоторых аминокислот, ограничение синонимичных положения к третьему положению, небольшой набор только из 20 аминокислот (вместо числа, приближающегося к 64), и отношение паттернов стоп-кодонов к паттернам кодирования аминокислот.
Три основные гипотезы касаются происхождения генетического кода. Многие модели относятся к одному из них или к гибриду:
Гипотезы касались множества сценариев: