мдс заболевание крови что это
Миелодиспластические синдромы
Миелодиспластические синдромы (МДС) объединяют группу злокачественных опухолевых заболеваний системы кроветворения.
При этих заболеваниях происходит нарушение созревания клеток костного мозга с изменением их строения и функциональных свойств.
Характерной, но не обязательной чертой заболевания является исход в острый лейкоз.
Эпидемиология
Заболеваемость МДС в среднем составляет 3-4 случая на 100 000 населения в год и увеличивается с возрастом.
Заболеваемость мужчин незначительно преобладает над заболеваемостью женщин. МДС в детском возрасте встречается крайне редко.
В 10-15% случаев МДС является осложнением проведенной химиотерапии и облучения по поводу другого онкологического заболевания.
Истинная заболеваемость МДС остается неизвестной. Связано это с бессимптомным течением заболевания у многих больных, трудностями диагностики и др. причинами.
Факторы риска
Известно, что факторы риска развития МДС и острых миелоидных лейкозов схожи.
В детском возрасте основными предрасполагающими факторами развития МДС являются генетические заболевания (синдромы Дауна, Фанкони, нейрофиброматоз, врожденный дискератоз и др.).
Генетическая предрасположенность отмечена и у лиц зрелого возраста, родители которых страдали МДС.
К химическим факторам риска относятся органические соединения (бензин и его производные, пестициды, растворители), а также неорганические (асбест, кварц, мышьяк) вещества.
МДС развивается чаще у курящих по сравнению с некурящими.
Более высокий риск возникновения МДС отмечен у работников сельского хозяйства, текстильной промышленности, лечебных учреждений, операторов машин, у лиц, проживающих вблизи заводов.
Наиболее изученным фактором риска является влияние химиопрепаратов и лучевого лечения. Чаще всего МДС диагностируется у больных, лечившихся по поводу рака молочной железы, множественной миеломы, лимфомы Ходжкина (лимфогранулематоза), неходжкинской лимфомы (лимфосаркомы), мелкоклеточного рака легкого.
Лучше всего МДС изучены у больных лимфомой Ходжкина. Частота развития МДС у этой категории больных колеблется от 1,5 до 10% и зависит от возраста, предшествующего лечения и длительности наблюдения.
Средний период от начала лечения болезни Ходжкина до установления диагноза МДС составляет около 4-6 лет. Убедительных данных об увеличении риска МДС при комбинации химиотерапии и облучения по сравнению с использованием только химиотерапии нет.
Клинические проявления
Признаки и симптомы у больных с МДС неспецифичны. У многих больных на протяжении ряда лет МДС протекает бессимптомно и выявляется лишь при обследовании по поводу других заболеваний.
Анемия (малокровие) является самым частым симптомом МДС и обнаруживается в 85-90% случаев. Большинство жалоб обусловлено выраженностью малокровия. Лейкопения (снижение числа лейкоцитов), отмечаемая у 50% больных, может быть причиной склонности к инфекционным осложнениям. В отдельных случаях повышение температуры может быть симптомом МДС. Иногда больные обращаются к врачу в связи со склонностью к кровотечениям из-за снижения числа тромбоцитов.
Несколько реже имеется увеличение лимфатических узлов. Увеличение, печени и лимфатических узлов при других вариантах МДС встречается редко.
Диагностика
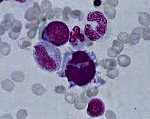
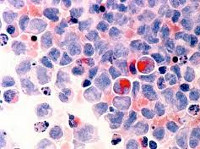
Выявление МДС основывается на обнаружении признаков дисплазии (нарушений формирования ткани) в одном или нескольких ростках кроветворения.
При этом выявленные изменения могут быть чрезвычайно разнообразными. Соотношение нормальных и измененных клеток у разных больных существенно варьируют.
Принято считать клеточные линии (ростки кроветворения) измененными, если число клеток с признаками дисплазии составляет более 10%.
В том случае, если число измененных клеток в костном мозге невелико (менее 10%), для достоверной диагностики МДС необходимо проводить цитогенетическое исследование.
Прогностические факторы
Прогноз (исход) МДС зависит от многих факторов.
Продолжительность жизни и вероятность трансформации (перехода) в острый лейкоз при МДС существенно варьируются.
Самая короткая продолжительность жизни (5-7 месяцев) отмечается у больных МДС, вызванным химиотерапией и облучением. Кроме того, прогноз менее благоприятный у пациентов старше 60 лет, мужского пола и при наличии симптомов интоксикации.
Среди показателей крови к неблагоприятным прогностическим признакам относятся:
Наибольшее прогностическое значение имеет степень опухолевой инфильтрации (поражения) костного мозга. Прогноз менее благоприятный, если число опухолевых клеток в костном мозге превышает 10%. Некоторые выявленные хромосомные изменения также отрицательно сказываются на исходе заболевания.
Лечение
Существует два подхода к лечению МДС:
— радикальный, направленный на достижение и сохранение полной ремиссии,
— нерадикальный, направленный на улучшение качества жизни больных.
При нерадикальном подходе допускается существование (персистирирование) болезни, что принципиально отличает лечение МДС от терапии острых лейкозов.
Методы лечения МДС:
Выбор различных направлений терапии определяется: возрастом больного, наличием донора стволовых клеток, возможностью проведения адекватной сопроводительной терапии, а также эффективностью отдельных препаратов, подобранных с учетом исходных клинико-лабораторных показателей.
Практически с помощью каждого из перечисленных методов терапии возможно достижение полной ремиссии. Препараты, улучшающие качество жизни, успешно используются у больных с благоприятным прогнозом (с длительным сроком жизни и низкой вероятностью развития острого лейкоза).
При благоприятном прогнозе с минимальными проявлениями заболевания можно ограничиться наблюдением за больным, пока показатели крови и костного мозга остаются стабильными.
При выраженном малокровии показано переливание эритроцитарной массы. В ряде случаев необходимо применение ростовых факторов, антитимоцитарного глобулина, индукторов дифференцировки клеток и пр.
При прогрессировании МДС проводится химиотерапия.
У больных с неблагоприятным прогнозом проводится химиотерапия по программам лечения острого миелоидного лейкоза. При невозможности химиотерапии или высоком риске осложнений допустимо использование противоопухолевых препаратов в малых дозах.
Такой подход может позволить улучшить качество жизни больных и провести адекватное лечение в более поздние сроки.
После достижения полной ремиссии и при невозможности проведения аллогенной трансплантации костного мозга может осуществляться аутологичная трансплантация костного мозга или периферических стволовых клеток.
Необходимо подчеркнуть, что единственным методом лечения, позволяющим существенно увеличить продолжительность жизни больных МДС, является аллогенная трансплантация костного мозга или периферических стволовых клеток.
Однако применение аллогенной трансплантации не всегда возможно в связи с пожилым возрастом большинства больных и отсутствием идентичного родственного донора.
До настоящего времени результаты лечения больных МДС остаются неудовлетворительными.
В связи с этим практически не существует общепринятых стандартов лечения, а определены лишь общие подходы к терапии для разных групп больных при разных вариантах заболевания.
Миелодиспластические синдромы
Вам поставили диагноз: Миелодиспластические синдромы
Наверняка Вы задаётесь вопросом: что же теперь делать?
Мы поможем вам справиться с болезнью и будем идти с вами рука об руку через все этапы вашего лечения.
Предлагаем вашему вниманию краткий, но очень подробный обзор данного заболевания.
Его подготовили высоко квалифицированные специалисты Отдела лекарственного лечения злокачественных новообразований МРНЦ имени А.Ф. Цыба и Отдела лекарственного лечения опухолей МНИОИ имени П.А. Герцена – филиалов ФГБУ «НМИЦ радиологии» Минздрава России под редакцией заведующих отделами, д.м.н. ФАЛАЛЕЕВОЙ Н.А. и д.м.н. ФЕДЕНКО А.А.
Филиалы и отделения, где лечат миелодиспластические синдромы
МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Отдел лекарственного лечения опухолей
Заведующий отделом, д.м.н. ФЕДЕНКО Александр Александрович
тел: 8 (494) 150 11 22
МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Отдел лекарственного лечения злокачественных новообразований
Заведующая отделом, д.м.н. ФАЛАЛЕЕВА Наталья Александровна
тел: 8 (484) 399 – 31-30
Миелодиспластические синдромы
(МДС) – разнородная группа заболеваний системы кроветворения, сопровождающаяся нарушением созревания кроветворных клеток с нарушениями их строения (дисплазией) и функции, а также повышенным риском развития острого лейкоза. МДС чаще всего сопровождаются снижением показателей общего анализа крови – цитопенией. Снижение уровня гемоглобина и числа эритроцитов обозначают термином анемия; числа лейкоцитов/нейтрофилов – лейкопенией/нейтропенией; уровня тромбоцитов – тробоцитопенией. Изредка может быть и увеличение числа лейкоцитов и/или тромбоцитов.
Ежегодная заболеваемость МДС в среднем составляет 3-4 случая на 100000 населения и увеличивается с возрастом. Основной контингент больных МДС представлен пожилыми людьми (средний возраст – 70 лет). В отдельную группу относят МДС, развившиеся после химиотерапии и/или лучевой терапии предшествующих заболеваний (преимущественно онкологических). Они составляют 10-15% от ежегодно выявляемых случаев МДС и называются вторичными МДС.
В связи с гетерогенностью заболевания возникает вопрос о выборе оптимальной терапии. Одним из основных факторов для решения этой задачи является определение прогностической группы (группы риска), к которой относится конкретный больной.
Каждый прогностический признак оценивается в баллах. В соответствии с суммарным числом баллов больных объединяют в 4 группы: низкого (0 баллов), промежуточного-1 (0,5-1,0 балл), промежуточного-2 (1,5-2,0 балла) и высокого (2,5 балла и выше) риска. Первые 2 группы (низкого и промежуточного-1 риска) характеризуются принципиально благоприятным прогнозом, а 2 остальные (промежуточного-2 и высокого риска) — неблагоприятным прогнозом. Определение прогноза необходимо для выбора лечения.
Существует несколько основных направлений в лечении МДС:
Эпигенетическая терапия: при МДС помимо мутаций обнаружено гиперметилирование генов – присоединение метильных групп к ДНК, «запрещающее» нормальное функционирование генов, ответственных за подавление опухолевого роста (гены опухолевой супрессии). Азацитидин и децитабин относятся к группе противоопухолевых средств, обладающих гипометилирующей активностью. Оба препарата зарегистрированы в России для лечения МДС. Исследования децитабина и азацитидина продемонстрировали увеличение продолжительности жизни больных, увеличение времени до эволюции МДС в острый лейкоз и улучшение качества жизни.
Химиотерапия: на протяжении последних 20 лет для лечения больных МДС с увеличенным числом бластных клеток, то есть преимущественно в группе принципиально неблагоприятного прогноза, используются схемы терапии острого миелоидного лейкоза. Применение стандартной химиотерапии позволяет получить высокую частоту полных ремиссий – 50-70%. Однако продолжительность ремиссий относительно короткая (как правило, менее 1,5 лет), а лечение сопровождается высокой токсичностью.
Трансплантация гемопоэтических стволовых клеток (трансплантация костного мозга): единственным методом лечения, позволяющим существенно увеличить продолжительность жизни больных МДС, является аллогенная трансплантация гемопоэтических стволовых клеток (аллоТГСК). Аллогенная ТГСК также позволяет получить наилучшие результаты по сравнению с другими методами лечения при вторичных МДС. Однако выполнение аллоТГСК не всегда возможно в связи с пожилым возрастом большинства больных и отсутствием идентичного родственного донора.
Иммуносупрессивная терапия: использование иммуносупрессивных препаратов, таких как циклоспорин А, демонстрирует наибольшую активность при гипопластическом варианте МДС, при отсутствии увеличения числа бластных клеток в костном мозге, нормальном кариотипе (без отклонений в наборе хромосом), наличии лимфоидных узелков (очаговых скоплений лимфоидных клеток) в трепанобиоптате, наличии клона клеток, составляющих субстрат пароксизмальной ночной гемоглобинурии (ПНГ-клон), и у HLA-DR-15 – позитивных молодых больных.
Терапия колониестимулирующими препаратами: эритропоэз-стимулирующие препараты – эритропоэтины (препараты, направленные на лечение анемии) фигурируют практически во всех рекомендациях по лечению МДС. Практически все специалисты сходятся во мнении о необходимости определения уровня эндогенного (собственного, вырабатываемого организмом) эритропоэтина до начала лечения. При уровне эндогенного эритропоэтина свыше 500 ед/л лечение эритропоэтином не показано, большая эффективность наблюдается при уровне эндогенного эритропоэтина в пределах 200 ед/л.
Сопроводительная (симптоматическая) терапия : к сопроводительной терапии при МДС относят гемотрансфузии (переливания) эритроцитов и тромбоцитов, антимикробную терапию, в том числе в комбинации с Г-КСФ или ГМ-КСФ, использование комплексонов (хелаторов) железа.
Программа лечения МДС основана на риск-адаптированном подходе в зависимости от групп прогноза, возраста, общего состояния больного. Иными словами, назначается индивидуальная терапия в зависимости от результатов полностью проведенного обследования. В некоторых случаях, когда проявления заболевания незначительны, может быть предложено только наблюдение у врача. Лечение некоторыми препаратами может проводиться как в условиях стационара, так и дома.
Филиалы и отделения Центра, в которых лечат миелодиспластические синдромы
ФГБУ «НМИЦ радиологии» Минздрава России обладает всеми необходимыми технологиями лучевого, химиотерапевтического и хирургического лечения, включая расширенные и комбинированные операции. Все это позволяет выполнить необходимые этапы лечения в рамках одного Центра, что исключительно удобно для пациентов.
Отдел лекарственного лечения злокачественных новообразований МРНЦ имени А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России
Заведующая отделом, д.м.н. ФАЛАЛЕЕВА Наталья Александровна
8 (484) 399 – 31-30, г. Обнинск, Калужской области
Отдел лекарственного лечения опухолей МНИОИ имени П.А. Герцена –филиал ФГБУ «НМИЦ радиологии» Минздрава России
Заведующий отделом, д.м.н. ФЕДЕНКО Александр Александрович
Миелодиспластический синдром
Миелодиспластический синдром – группа гематологических заболеваний, при которых наблюдаются цитопения, диспластические изменения костного мозга и высокий риск возникновения острого лейкоза. Характерные симптомы отсутствуют, выявляются признаки анемии, нейтропении и тромбоцитопении. Диагноз устанавливается с учетом данных лабораторных анализов: полного анализа периферической крови, гистологического и цитологического исследования биоптата и аспирата костного мозга и т. д. Дифференциальный диагноз может представлять значительные затруднения. Лечение – переливание компонентов крови, химиотерапия, иммуносупрессивная терапия, пересадка костного мозга.
Общие сведения
Миелодиспластический синдром – группа заболеваний и состояний с нарушениями миелоидного кроветворения и высоким риском развития острого лейкоза. Вероятность развития увеличивается с возрастом, в 80% случаев данный синдром диагностируется у людей старше 60 лет. Мужчины страдают несколько чаще женщин. У детей миелодиспластический синдром практически не встречается. В последние десятилетия гематологи отмечают увеличение заболеваемости среди лиц трудоспособного возраста. Предполагается, что причиной «омоложения» болезни могло стать существенное ухудшение экологической обстановки.
До недавнего времени лечение миелодиспластического синдрома было только симптоматическим. Сегодня специалисты разрабатывают новые методы терапии, однако эффективное лечение этой группы болезней все еще остается одной из самых сложных проблем современной гематологии. Пока прогноз при миелодиспластическом синдроме, в основном, зависит от особенностей течения болезни, наличия или отсутствия осложнений. Лечение осуществляют специалисты в сфере онкологии и гематологии.
Причины и классификация миелодиспластического синдрома
С учетом причин развития различают два типа миелодиспластического синдрома: первичный (идиопатический) и вторичный. Идиопатический вариант выявляется в 80-90% случаев, диагностируется преимущественно у пациентов старше 60 лет. Причины возникновения установить не удается. В числе факторов риска первичного миелодиспластического синдрома – курение, повышенный уровень радиации при выполнении профессиональных обязанностей или проживании в неблагоприятной экологической зоне, частый контакт с бензином, пестицидами и органическими растворителям, некоторые наследственные и врожденные заболевания (нейрофиброматоз, анемия Фанкони, синдром Дауна).
Вторичный вариант миелодиспластического синдрома наблюдается в 10-20% случаев, может возникать в любом возрасте. Причиной развития становится химиотерапия или радиотерапия по поводу какого-то онкологического заболевания. В число лекарственных средств с доказанной способностью вызывать миелодиспластический синдром включают циклофосфан, подофиллотоксины, антрациклины (доксорубицин) и ингибиторы топоизомеразы (иринотекан, топотекан). Вторичный вариант отличается более высокой резистентностью к лечению, более высоким риском развития острого лейкоза и более неблагоприятным прогнозом.
В современной редакции классификации ВОЗ различают следующие типы миелодиспластического синдрома:
Симптомы миелодиспластического синдрома
Клиническая симптоматика определяется степенью нарушений миелопоэза. При мягко протекающих расстройствах возможно длительное бессимптомное или стертое течение. Из-за слабой выраженности клинических проявлений некоторые больные не обращаются к врачам, и миелодиспластический синдром обнаруживается во время проведения очередного медицинского осмотра. При преобладании анемии наблюдаются слабость, одышка, плохая переносимость физических нагрузок, бледность кожных покровов, головокружения и обморочные состояния.
При миелодиспластическом синдроме с тромбоцитопенией возникает повышенная кровоточивость, отмечаются десневые и носовые кровотечения, на коже появляются петехии. Возможны подкожные кровоизлияния и меноррагии. Миелодиспластический синдром с выраженными нейтропенией и агранулоцитозом проявляется частыми простудами, стоматитом, синуситом или стрептодермией. В тяжелых случаях возможно развитие пневмонии или сепсиса. Инфекционные заболевания нередко вызываются грибками, вирусами или условно-патогенными микробами. У каждого пятого пациента с миелодиспластическим синдромом выявляется увеличение лимфоузлов, селезенки и печени.
Диагностика миелодиспластического синдрома
При исследовании костного мозга количество клеток обычно нормальное либо повышенное. Уже на ранних стадиях обнаруживаются признаки дизэритропоэза. Количество бластов зависит от формы миелодиспластического синдрома, может быть нормальным либо увеличенным. В последующем наблюдаются дисгранулоцитопоэз и дисмегакариоцитопоэз. У некоторых больных признаки дисплазии костного мозга выражены очень слабо. В процессе цитогенетического исследования у ¾ больных выявляются хромосомные нарушения. Дифференциальный диагноз миелодиспластического синдрома проводят с В12-дефицитной анемией, фолиево-дефицитной анемией, апластической анемией, острым миелолейкозом и другими острыми лейкозами.
Лечение и прогноз при миелодиспластическом синдроме
Тактика лечения определяется выраженностью клинической симптоматики и лабораторных изменений. При отсутствии явных признаков анемии, геморрагического синдрома и инфекционных осложнений осуществляется наблюдение. При миелодиспластическом синдроме с выраженной анемией, тромбоцитопенией и нейтропенией, а также при высоком риске возникновения острого лейкоза назначают сопроводительную терапию, химиотерапию и иммуносупрессивную терапию. При необходимости осуществляют пересадку костного мозга.
Сопроводительная терапия является самым распространенным методом лечения миелодиспластического синдрома. Предусматривает внутривенные инфузии компонентов крови. При длительном применении может провоцировать повышение уровня железа, влекущее за собой нарушения деятельности жизненно важных органов, поэтому переливания гемокомпонентов производят при одновременном приеме хелаторов (лекарственных средств, связывающих железо и способствующих его выведению).
Иммуносупрессоры эффективны при лечении миелодиспластического синдрома с отсутствием хромосомных аномалий, наличием гена HLA-DR15 и гипоклеточном костном мозге. Химиотерапию применяют при невозможности трансплантации костного мозга. Высокие дозы препаратов используют при трансформации миелодиспластического синдрома в острый лейкоз, а также при рефрактерных анемиях с избытком бластов при нормоклеточном и гиперклеточном костном мозге, низкие – при невозможности пересадки костного мозга. Наряду с перечисленными средствами пациентам назначают гипометилирующие средства (азацитидин). Наиболее надежным способом достижения полноценной длительной ремиссии является трансплантация костного мозга.
Прогноз зависит от типа миелодиспластического синдрома, количества хромосомных аномалий, необходимости в регулярных переливаниях компонентов крови, выраженности клинических проявлений и наличия осложнений. Различают 5 групп риска. Средняя выживаемость больных миелодиспластическим синдромом, входящих в группу с самым низким уровнем риска, составляет более 11 лет; с самым высоким – около 8 месяцев. Вероятность отторжения костного мозга после трансплантации – около 10%.
Миелодиспластический синдром: причины, симптомы, лечение
Термин « миелодиспластический синдром » (сокращённо МДС) объединяет различные патологии, при которых обнаруживаются цитопения (понижение концентрации форменных элементов крови), дисплазия (неправильное развитие) гемоцитобластов (предшественников кровяных клеток), гипоклеточность или гиперклеточность костного мозга.
МДС встречается достаточно редко – 3-5 случаев на 100 тысяч населения. Но после 60 лет частота болезни повышается до 20-40 случаев ( https://www.eduherald.ru/pdf/2021/2/20538.pdf ).
Причины болезни
Точные причины МДС пока не удалось установить. Известно, что в 10-20% случаев патология развивается у людей, проходивших лучевую или химиотерапевтическую терапию ( https://cyberleninka.ru/article/n/mielodisplasticheskiy-sindrom/viewer ).
Ученые предполагают, что спровоцировать миелоидный синдром способен также парвовирус В19.
Повышают риск возникновения патологии постоянная работа с некоторыми химическими веществами (пестицидами, бензином, органическими растворителями), неблагоприятная экологическая ситуация, курение, некоторые врожденные и наследственные болезни.
Под влиянием повреждающих факторов в стволовых клетках возникают мутации, которые способствуют развитию МДС. Постепенно они накапливаются, способствуя переходу болезни в лейкоз.
Симптомы патологии
Признаки МДС зависят от того, дефицит каких кровяных клеток испытывает организм.
Выделяют 3 группы клинических проявлений:
У некоторых пациентов в число симптомов миелодиспластического синдрома входят увеличение размеров селезенки (спленомегалия) и печени (гепатомегалия).
Диагностика МДС
Основной метод диагностики миелодиспластического синдрома – исследование крови. При МДС возможно понижение как одного показателя, так и их комбинация. Диагноз ставят только при устойчивой (не менее полугода) цитопении, если не найдены другие причины.
Если возникает подозрение на миелодиспластический синдром, делают трепанобиопсию и пункцию костного мозга. Полученный биоматериал подвергают гистологическому и цитологическому исследованию.
Чтобы исключить другие причины цитопении, пациента направляют на дополнительные лабораторные и инструментальные исследования, которые могут включать:
Цитопения сопровождает различные заболевания. Поэтому важно исключить другие причины: рак, аутоиммунные заболевания, хронические инфекции, нарушение гемопоэза, отравление бензином или тяжелыми металлами, нехватку меди, избыток цинка, побочное действие лекарств.
Чтобы дифференцировать миелодиспластический синдром от миелоидного лейкоза, определяют число бластных клеток. Согласно ВОЗ, если показатель превышает 20%, то диагностируют острый лейкоз ( https://cyberleninka.ru/article/n/mielodisplasticheskiy-sindrom/viewer ).
Лечение МДС
Выбор способа лечения зависит от степени и прогрессирования цитопении, группы риска, имеющихся сопутствующих заболеваний.
Единственный действенный метод лечения, обеспечивающий лечение , – пересадка костного мозга.
Выделяют 3 основные способа лечения:
o Чтобы купировать либо предотвратить кровоточивость, прибегают к трансфузии тромбоцитов.
o При гипопластическом типе кроветворения эффективное действие оказывают иммунодепрессанты, которые защищают костный мозг от иммунной атаки.
В клинике Спиженко лечение подбирают индивидуально для каждого пациента в соответствии с международными рекомендациями и утвержденными протоколами.