надъядерный паралич код по мкб 10
Прогрессирующая надъядерная офтальмоплегия (Стила-Ричардсона-Ольшевского)
Рубрика МКБ-10: G23.1
Содержание
Определение и общие сведения [ править ]
Прогрессирующий надъядерный паралич
Распространенность консервативно оценивается примерно в 1 / 16,600.
Этиология и патогенез [ править ]
Клинические проявления [ править ]
Прогрессирующий надъядерный паралич обычно проявляется в течение шестого или седьмого десятилетия жизни. Были описаны пять клинических вариантов с клиникопатологическими корреляциями: классический прогрессирующий надъядерный паралич (синдром Ричардсона) и четыре нетипичных варианта прогрессирующего надъядерного паралича: ПНП-паркинсонизм, чистый ПНП с акинезией и нарушением походки, синдром ПНП-кортикобазальный синдром и ПНП-прогрессрующая медленная афазия.
Синдром Ричардсона является наиболее распространенным клиническим вариантом и проявляется шаткой походкой и падениями, обусловленной постуральной атксией, когнитивными нарушениями и замедлением вертикальных саккадических движений глаз. Постепенно у пациентов развиваются другие проблемы, такие как нарушения речи, паралич взора и трудности с глотанием.
ПНП-паркинсонизм характеризуется выраженным ранним паркинсонизмом (тремор, брадикинезия конечностей, ригидность), но не падениями и когнитивными изменениями. На протяжении многих лет у пациентов в конечном счете развиваются клинические особенности, характерные для синдрома Ричардсона.
ПНП с акинезией и скованной походкой, характеризуется прогрессирующим нарушением походки, речи и письма в начале болезни. Позже могут наблюдаться осевая ригидность, неподвижность мимики и надъядерный парез взора.
ПНП-кортикобазальный синдром характеризуется прогрессирующей асимметричной диспраксией, ригидностью конечностей, брадикинезией и прогрессирующей постуральной нестабильностью.
ПНП-прогрессрующая медленная афазия характеризуется речевыми аномалиями (апраксия речи, аграматизм, фонематические ошибки). Моторные симптомы появляются позже в ходе болезни.
Прогрессирующий надъядерный паралич характеризуется потерей нейронов, глиозом с астроцитарными бляшками и накоплением тау-иммунореактивных нейрофибриллярных клубков в определенных областях мозга. Различия в скорости и областях накопления фосфорилированного тау-белка коррелируют с пятью клиническими вариантами.
Прогрессирующая надъядерная офтальмоплегия (Стила-Ричардсона-Ольшевского): Диагностика [ править ]
Диагноз основан на клинической картине и нейропсихологической оценке.
Дифференциальный диагноз [ править ]
Дифференциальный диагноз включает болезнь Паркинсона и другие атипичные паркинсонические расстройства, такие как множественную системную атрофию и кортикобазальную дегенерацию. Схожие нарушения движения глаз могут возникать при болезни Ниманна-Пика типа С и болезни Уиппла.
Прогрессирующая надъядерная офтальмоплегия (Стила-Ричардсона-Ольшевского): Лечение [ править ]
Эффективного лечения болезни нет. Некоторые лекарства, в зависимости от клинического варианта, снижают симптоматику и улучшают качество жизни (например, леводопа у пациентов с ПНП-паркинсонизмом). Амантадин может улучшить качество походки, а другие антихолинергические препараты иногда улучшают нарушения речи и речи.
Профилактика [ править ]
Прочее [ править ]
Постепенно пациенты становятся прикованы к инвалидным коляскам из-за частых падений. Трудности с дыханием и глотанием, а также инфекции являются основными причинами смерти, как правило, через 6-12 лет после начала заболевания.
Прогрессирующий надъядерный паралич
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.

Код по МКБ-10
Причины прогрессирующего надъядерного паралича
Причина заболевания неизвестна. Показана дегенерация нейронов базальных ядер и ствола мозга, выявлены нейрофибриллярные клубочки, содержащие фосфорилированный тау-протеин. В базальных ганглиях и глубоком белом веществе возможны лакунарные кисты.

Симптомы прогрессирующего надъядерного паралича
Типичен дебют в позднем среднем возрасте. Обычно появляются трудности при взгляде вверх (без разгибания шеи), а также при подъеме и спуске с лестницы. Хотя произвольные движения глаз, особенно вертикальные, затруднены, но рефлекторные сохранны. Движения замедляются, мышцы становятся ригидными, развивается аксиальная дистония, и появляется тенденция к падению назад. Обычны дисфагия и дизартрия с эмоциональной лабильностью (псевдобульбарный паралич), эти нарушения прогрессируют, как при множественных инсультах. В итоге развивается деменция.
Диагностика прогрессирующего надъядерного паралича
Диагноз прогрессирующий надъядерный паралич ставят по клиническим данным.

Прогрессирующий надъядерный паралич — это дегенеративное церебральное заболевание с преимущественным поражением среднего мозга, ядерно-корковых путей, подкорковых образований. Составляющими клинической картины выступают акинетико-ригидная форма паркинсонизма, атаксия, офтальмоплегия, когнитивное снижение, псевдобульбарный синдром. Диагностика осуществляется по клиническим данным, результатам церебральной МРТ и цереброваскулярных исследований. В терапии препаратами выбора являются леводопа, мемантин, антидепрессанты из группы ингибиторов обратного захвата серотонина.
МКБ-10
Общие сведения
Прогрессирующий надъядерный паралич (ПНП) — дегенеративное поражение головного мозга неясной этиологии. Наряду с болезнью Альцгеймера, мультисистемной атрофией, кортикобазальной дегенерацией, болезнью Пика, ПНП относится к таупатиям, характеризующимся образованием включений тау-протеина в нейронах и глиальных клетках. Прогрессирующий надъядерный паралич впервые был подробно описан в 1963-64 годах канадскими неврологами Стилом и Ричардсоном в соавторстве с патоморфологом Ольшевским, в честь которых носит название синдром Стила-Ричардсона-Ольшевского. Распространённость заболевания согласно различным информационным источникам варьирует в пределах 1,4-6,4 случая на 100 тыс. населения. Манифестация клинической симптоматики приходится на возрастной период от 55 до 70 лет, с возрастом вероятность развития заболевания увеличивается. Лица мужского пола в большей степени подвержены болезни по сравнению с женщинами.
Причины ПНП
Этиофакторы, запускающие дегенеративные процессы определённой церебральной локализации, остаются неизвестными. Большинство случаев болезни имеют спорадический характер. Отдельные семейные варианты с предположительным аутосомно-доминантным наследованием были выявлены после 1995 года. Молекулярно-генетические исследования показали, что некоторые формы ПНП обусловлены дефектами кодирующего тау-белок гена, локализованного в локусе 17q21.31. Наиболее вероятным представляется мультифакторный механизм возникновения патологии, реализующийся на фоне генетической предрасположенности.
Патогенез
Ведущим патогенетическим механизмом считается дисметаболизм церебральных внутриклеточных белков, сопровождающийся избирательной агрегацией отдельных белков (тау-протеина, убиквитина) в определённых группах мозговых клеток. Патологические включения нарушают жизнедеятельность нейронов, запускают процесс деградации и запрограммированной гибели (апоптоза). Дегенеративные изменения носят селективный характер, распространяются преимущественно на средний мозг, зубчатые мозжечковые ядра и подкорковые структуры: черную субстанцию, бледный шар, таламус, ретикулярную формацию, субталамическое ядро. В меньшей степени поражается кора префронтальных и височных зон.
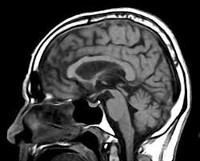
Патоморфологическая картина ПНП представлена наличием нейрофибриллярных клубочков, глиальных включений, нитевидных белковых образований в нейронах указанных церебральных структур. Макроскопически определяется атрофия среднего мозга с существенным уменьшением его сагиттального размера. Поражение среднего мозга обуславливает надъядерный паралич глазодвигательной мускулатуры, дегенерация кортико-бульбарных трактов — псевдобульбарные проявления. Нейрохимические исследования выявляют пониженную концентрацию дофамина в стриатуме, лежащую в основе паркинсонического симптомокомплекса.
Симптомы ПНП
Прогрессирующий надъядерный паралич характеризуется неспецифичным клиническим дебютом. Симптоматика этого периода представлена непривычной утомляемостью, сниженной работоспособностью, цефалгиями, головокружением, пониженным настроением, сужением круга интересов, нарушениями сна, включающими бессонницу ночью и гиперсомнию днём. В последующем присоединяются симптомы акинетико-ригидного паркинсонизма. Постуральный тремор у большинства пациентов отсутствует. Мышечная ригидность выражена преимущественно в аксиальной мускулатуре — мышцах, идущих вдоль шейного отдела позвоночника, соединяющих его с черепом. Больные жалуются на скованность в шее, спине. Повышение тонуса в задних мышцах шеи приводит к типичному «горделивому» положению головы пациента. Характерна паркинсоническая атаксия, обусловленная расстройством координации положения туловища и нижних конечностей относительно центра тяжести. Затруднения в поддержании равновесия в процессе ходьбы приводят к частым падениям назад.
Отличительной особенностью ПНП выступает офтальмоплегия, возникающая в среднем спустя 2-3 года от дебюта заболевания. На фоне замедленного движения глазных яблок происходит паралич взора в вертикальной плоскости, пациент не может опустить глаза вниз. Из-за редкого моргания больной ощущает дискомфорт, жжение в глазах. Возможны расплывчатость зрения, расстройство конвергенции, блефароспазм. Прогрессирующий надъядерный офтальмопарез сопровождается ограничением взора вниз и вверх, со временем может приводить к глазодвигательным нарушениям в горизонтальной плоскости. При развитии полной офтальмоплегии формируется ретракция верхних век, что придаёт лицу удивлённое выражение.
В клинической картине ПНП относительно рано возникают псевдобульбарные проявления: дизартрия, дисфагия, насильственный плач или смех. Происходят изменения личностно-эмоциональной сферы, больные становятся замкнутыми, апатичными, демотивированными, безразличными. Когнитивные нарушения в большинстве случаев присоединяются в разгаре болезни, в 10-30% случаев — на стадии дебюта. Характерно интеллектуальное снижение, расстройства абстрактного мышления и памяти, зрительно-пространственная апраксия, элементы агнозии. Деменция наблюдается у 60% пациентов с 3-летним стажем заболевания.
Осложнения
В начальном периоде падения больного без возможности скоординировать свои движения приводят к ушибам и переломам. Спустя несколько лет прогрессирующий олигобрадикинетический синдром приковывает пациентов к постели. При отсутствии должного ухода обездвиженность опасна развитием контрактур суставов, пролежней, застойной пневмонии. Прогрессирующий псевдобульбарный паралич обуславливает попёрхивание пищей с риском асфиксии, аспирационной пневмонии. Ночные апноэ могут стать причиной внезапной смерти во сне. Серьёзным осложнением является присоединение интеркуррентных инфекций (пневмонии, цистита, пиелонефрита), поскольку на фоне сниженного иммунитета существует высокий риск развития сепсиса.
Диагностика
Вероятными ранними критериями ПНП являются начало после 40-летнего возраста, прогрессирующий характер, парез горизонтального взора, выраженная постуральная неустойчивость с эпизодами падений. Постановка достоверного диагноза возможна при наличии гистологически подтверждённых патогномоничных для ПНП изменений в тканях мозга. Перечень необходимых диагностических исследований включает:
Дифференциальная диагностика осуществляется с болезнью Паркинсона, вторичным паркинсонизмом травматической, инфекционной, токсической, сосудистой этиологии, деменциями альцгеймеровского типа, поздней формой нейроакантоцитоза. От классической болезни Паркинсона надъядерный паралич отличается симметричностью паркинсонизма с момента его появления, быстрым развитием когнитивных расстройств, офтальмоплегией, ретроколлисом, выраженной атаксией, малым эффектом дофаминергической терапии. Достоверно дифференцировать прогрессирующий надъядерный паралич от прочих таупатий можно по особенностям патоморфологических изменений.
Лечение ПНП
Эффективная терапия, способная остановить прогрессирующий дегенеративный процесс, пока не найдена. Осуществляется симптоматическое лечение, направленное на облегчение состояния пациента. Проведенные фармакотерапевтические исследования не сопровождались плацебо-контролем, слабо доказывают эффективность медикаментозной терапии. В лечении когнитивных нарушений возможно применение мемантина, ингибиторов ацетилхолинэстеразы, для коррекции психоэмоциональной сферы — антидепрессантов с психоактивирующим действием (флуоксетина, пароксетина).
Большинство неврологов считают необходимым назначение стартовой дофаминергической терапии. У половины больных наблюдается определённое облегчение состояния на фоне приёма препаратов леводопы, однако данный эффект длится не более двух лет. Противопаркинсонические фармпрепараты прочих групп (ингибиторов МАО, агонистов дофаминовых рецепторов, ингибиторов КОМТ) не показали своей эффективности.
Прогноз и профилактика
При надъядерном параличе наблюдается безостановочное прогрессирование симптоматики. Проводимая терапия не оказывает существенного эффекта на течение болезни. Продолжительность жизни пациентов колеблется в пределах 5-15 лет. Летальный исход обусловлен интеркуррентными инфекциями, затяжным апноэ сна, аспирационной пневмонией. В связи с отсутствием ясного понимания этиологии и патогенеза нозологии разработка профилактических мероприятий не представляется возможной, исследования заболевания и методов его лечения продолжаются.
Прогрессирующий надъядерный паралич
Резюме
Открытие
Синдром Гуама, также идентифицированы P г Джон Стил, является особой формой PSP от острова Гуам в районе Тихого океана. Следовательно, это также атипичный паркинсонический синдром, который часто ассоциируется с болезнью Паркинсона с боковым амиотрофическим склерозом и деменцией.
Объяснение термина
Патофизиология
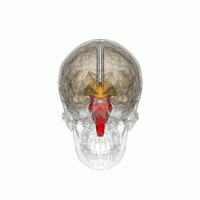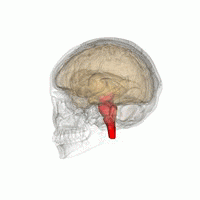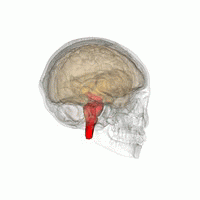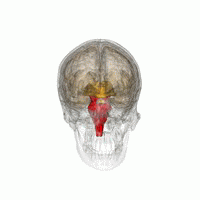
Основные области мозга, пораженные PSP:
Эпидемиология
От него страдают десятки тысяч человек в США и Европе (по оценкам, от 40 000 до 60 000 человек). У мужчин он немного больше, чем у женщин (разница около 2%). В основном это происходит у людей в возрасте от 55 до 65 лет.
Диагностический
Симптомы
Порядок появления симптомов варьируется от одного человека к другому, а сами симптомы являются общими для других патологий, диагностика остается сложной. Диагноз можно заподозрить клинически на фоне нарушений осанки, аксиальных признаков паркинсонизма и глазодвигательных нарушений. При клиническом обследовании выявляются медлительность взгляда вверх, ригидность шейки матки, в более общем плане моторный дефицит в сагиттальной плоскости, лобные подкорковые когнитивные расстройства и трудности с остановкой повторяющихся моторных движений, таких как последовательность из трех аплодисментов.
Дефицит моторики в сагиттальной плоскости объясняет вертикальные глазные затруднения, спонтанное отставание при остановке по умолчанию при коррекции позы, затруднение глотания. Глазодвигательная недостаточность также вызывает падение вперед, пациент больше не может тайно проверять наличие препятствий на земле на своем пути (адаптация к окружающей среде пациента).
Среди основных симптомов и клинических признаков необходимо помнить:
Дополнительные тесты
Как правило, диагноз PSP ставится при невропатологическом обследовании в зависимости от топографического распределения поражений, интерпретация которого может быть общей для других таупатий, таких как DCB и некоторые ЛВД лобного типа.
На сегодняшний день создано пять вариантов ПСП:
Дифференциальная диагностика
Основные дифференциальные диагнозы:
Диагностическая ошибка по-прежнему остается важной, в среднем более трех лет, с большими различиями. Считается, что PSP составляет не менее 5% паркинсонических синдромов, поэтому он является вторым паркинсоническим синдромом после болезни Паркинсона.
Генетика и факторы риска
С начала 2013 года мы, к сожалению, знали, что для Davunetide в исследовании III фазы ни одна из вторичных или исследовательских конечных точек не показала признаков изменения. Остается надеяться, что, несмотря ни на что, эта неудача внесет свой вклад в борьбу с этим заболеванием.
Прогноз
Заболевание не является прямым смертельным исходом, с другой стороны, оно сокращает продолжительность жизни тех, кто им болен. Учитывая диагностическую ошибку, с одной стороны, и возраст пациента и общее состояние здоровья, с другой стороны, эта ожидаемая продолжительность жизни пациента с диагнозом PSP редко превышает 15 лет. С другой стороны, средние значения в этой области не имеют значения, поскольку они не отражают значительных различий между пациентами. Наиболее приемлемый средний срок составляет около 7 лет. Основными причинами сокращения продолжительности жизни или даже смертности у пациентов с ПСП могут быть:
Исследовать
Диагностический
Посмертное невропатологическое обследование / Анатомопатология
Как и в случае с другими нейродегенеративными заболеваниями, по сей день он остается единственным обследованием, позволяющим поставить окончательный диагноз прогрессирующего надъядерного паралича. В этом отношении пациенты и их семьи, которые жертвуют свой мозг, позволяют добиться значительного прогресса в понимании и борьбе с PSP и нейродегенеративными заболеваниями.
Другие подходы
Европейский проект NNIPPS, в котором участвуют 800 пациентов, был предложен в 2001 году для изучения клинических, когнитивных, нейрорадиологических и гистологических особенностей PSP. Окончательные результаты, опубликованные в 2011 году, к сожалению, подтвердили, что испытания не дали ожидаемых результатов по эффективности. Также проводятся исследования природы глазодвигательных нарушений и нарушений равновесия, характерных для этого состояния.
Однако с середины до конца 1990-х гг. Классификация нейродегенеративных патологий усложнилась.
Благодаря молекулярным и генетическим подходам для нейродегенеративных заболеваний появилась новая классификация и определение, основанные на природе составляющих нейропатологических поражений:
Белок FKBP52 действует как своего рода белок против тау-белка, поскольку высокое присутствие FKBP52 предотвращает накопление белков тау-белка в нейронах. Таким образом, белок FKBP52 изучается с двойной задачей: обеспечить лучший скрининг путем измерения количества белка FKBP52 и разработать лекарства, блокирующие развитие тау-патологии.
Все эти эксперименты будут продолжены для получения более широких результатов, позволяющих моделировать терапевтические процессы, в частности, на основе стратегий, нацеленных на белок тау.
Механизмы
Тау-белок, белок, сильно вовлеченный в процесс
Кодирование белков подчиняется сложным биохимическим и молекулярным механизмам, чтобы принять на себя нормальные функции жизни или смерти ( апоптоз ) наших клеток.
В 1980-х годах нейрофибриллярная дегенерация была связана с тау-белком, который долгое время игнорировался исследованиями, но теперь вызывает новый интерес.
Течение болезни соответствует течению тау в головном мозге. Патология тау-белка имеет биохимический и морфологический признак нейрофибриллярной дегенерации. С другой стороны, нельзя ожидать очень точной взаимосвязи между пораженной областью и конкретным когнитивным признаком, потому что задействованы другие отягчающие факторы.
Чем больше развивается тау-патология в коре, тем более изменчивым становится путь в зависимости от индивидуальной уязвимости. Вариабельность вовлечения областей сначала ассоциативной, а затем первичной коры вызывает заметные межиндивидуальные клинические различия. Вот почему каждое нейродегенеративное заболевание имеет довольно точный и постоянный общий и статистический профиль, но каждый случай имеет свою специфику. Этот профиль развития можно представить, например, для болезни Альцгеймера в 10 стадиях, характерных для приступов.
Организация лечения, ухода и исследований во Франции
С 28 февраля 2011 г. был обновлен Национальный план по редким заболеваниям (PNMR), его бюджет составляет 180 миллионов евро.
Надъядерный паралич код по мкб 10
Потребность в классификации любой группы заболеваний определяется необходимостью более четкого понимания их структуры, их природы, особенностей клинических проявлений, возможностью прогнозировать их течение, разработки более рациональных и эффективных подходов к их лечению.
Развитие клинической неврологии было тесно связано с созданием и развитием топической диагностики поражений нервной системы. Успехи топической диагностики всегда были предметом профессиональной гордости клинических неврологов. Однако при изучении патологии базальных ганглиев традиционные представления о топической диагностике не подтвердились: попытки связать клинические проявления экстрапирамидных расстройств с поражением определенных структур базальных ганглиев оказались безуспешными.
Примером такой попытки может служить работа Jörg Baumann (1963), который предложил выделять в группе экстрапирамидных расстройств следующие клинико-топические синдромы: 1) палеостриарный синдром (т.е. поражение бледного шара), к которому относили болезнь Паркинсона, другие болезни с синдромом паркинсонизма, болезнь Галлервордена–Шпатца и эссенциальный тремор; 2) неостриарный синдром (т.е. поражение хвостатого ядра и скорлупы), который проявляется разными формами гиперкинезов и дискинезий – болезнь Гентингтона, другие формы хореи, разные формы дистонии; 3) оливоруброцеребеллярный синдром (совокупность поражения структур «топографического церебрального треугольника», включающего системы красных ядер, олив и мозжечка), при котором наблюдается миоклоническая диссинергия Ханта [4].
В нашей стране в те же годы свои подходы к классификации экстрапирамидных расстройств предложил Л.С.Петелин. Применяя анатомо-патофизиологический подход, он систематизировал гиперкинезы в соответствии с уровнем поражения структур головного мозга. Он писал: «Такой подход дает возможность определить структуру гиперкинеза в зависимости от физиологических параметров моторных центров разных уровней нервной системы» [3]. При этом он выделял: 1) гиперкинезы стволового уровня (все виды органического тремора, паркинсонический тремор покоя, миоклонии, стереотипии); 2) гиперкинезы преимущественно подкоркового уровня (хорея, атетоз, торсионная дистония, баллизм); 3) подкорково-корковые гиперкинезы (разные формы миоклонии).
Таблица 1. Нейронные круги обратной связи ядер экстрапирамидной системы и синдромы нарушения функции нейронных колец (по Л.С.Петелину, 1970)
| Нейронное кольцо | Структуры мозга, объединенные в нейронное кольцо | Неврологические синдромы при нарушении функции кольца |
| I | 8, 6 и 4-е поля коры – стриопаллидум – таламус – кора | Хореоатетоз и торсионная дистония |
| II | Кора – стриопаллидум – нигроретикулярные структуры – таламус – кора | Паркинсоническое дрожание и другие виды тремора |
| III | Руброталамические – дентаторубральные образования | Интенционное дрожание |
| IV | Кора – стриопаллидум – красное ядро – олива – зубчатое ядро – таламус – кора | Миоклонии |
Анализ своей гипотезы и данных других авторов позволил ему предложить схематическое изображение возможного взаимодействия центров экстрапирамидной системы разного уровня [2]. В такой схеме описывались нейронные круги и выделялись синдромы нарушения функции 4 нейронных колец при экстрапирамидных расстройствах (табл. 1).
Однако анатомо-клинические классификации не нашли практического применения. Сложность вопроса классификации экстрапирамидных расстройств лежит еще и в плоскости терминологических понятий. Экстрапирамидные расстройства связывают с патологией базальных ганглиев, которые традиционно рассматривают как подкорковые узлы в глубоких отделах полушарий головного мозга.
В то же время формально термин «экстрапирамидные структуры» предполагает, что к ним могут быть причислены все образования и системы вне пирамидной кортикоспинальной системы: мозжечковая, вестибуло- и ретикулоспинальная, а также такие структуры, как зрительный бугор, красные ядра и черная субстанция, которые формально не относятся ни к пирамидной системе, ни к базальным ганглиям. Более того, теперь хорошо известно, что основные эфферентные пути, несущие импульсы от базальных ганглиев, пройдя через зрительный бугор, направляются к клеткам коры, чтобы принять участие в формировании пирамидного пути. На протяжении этого пути волокна двух систем смешиваются и следуют вместе, за исключением ограниченного участка – пирамид продолговатого мозга, в которых волокна пирамидной системы следуют изолированно. Таким образом, термины «экстрапирамидные структуры» и «экстрапирамидные расстройства» носят условный характер.
Как писал П.Мильнер (1973), «само подразделение моторной системы на пирамидную и экстрапирамидную является источником путаницы и ошибок. Возможно, следствием исторического заблуждения является представление, что пирамидная система является единственной двигательной системой. Поэтому те отделы мозга, участие которых в двигательной функции было выявлено позднее, были объединены под названием „экстрапирамидная система“. Трудно провести четкую функциональную грань между этими системами. Не обособлены они и анатомически, за исключением короткой части пути через продолговатый мозг» [1].
Один из основоположников современного учения об экстрапирамидной патологии, американский невролог S.Fahn, создавая в 1968 г. специализированную клинику для пациентов с болезнью Паркинсона, принял решение, что в этой клинике также будут находиться больные с разными формами нарушения движений, как с гипокинетическими (паркинсонизм, пластическая мышечная ригидность), так и с гиперкинетическими формами (гиперкинезы, разные формы дистонии и дискинезии). Он назвал свое отделение «клиника для больных с нарушением движений» (movement disorders clinic). Это название тоже имело очевидное условное ограничение, так как S.Fahn не предполагал включать в эту группу больных с другими нарушениями движений: при пирамидных парезах и спастичности, а также больных с поражением мотонейронов передних рогов серого вещества спинного мозга. Однако, как показало время, предложенное название – «нарушение движений» – вписалось в современную неврологическую терминологию. Теперь с таким названием функционируют национальные и региональные общества неврологов, собираются конгрессы и конференции, издаются журналы [5].
Первая и единственная масштабная попытка создать общепризнанную классификацию экстрапирамидных расстройств была осуществлена под эгидой Всемирной федерации неврологии специальной комиссией, созданной по инициативе американского невролога профессора Melvin D. Yahr, председателя секции экстрапирамидных расстройств Всемирной федерации неврологии той поры. В комиссию входили всемирно известные неврологи: Andre Barbeau (Канада), Roger C. Devoisin (США), Franz Gerstenbrandt (Австрия), C.D.Marsden (Великобритания). Эта комиссия под председательством профессора Johannes P.W.F. Lakke (Нидерланды) опубликовала в 1981 г. доклад «Классификация экстрапирамидных расстройств. Предложения для международной классификации и глоссария терминов» [12]. Обращает на себя внимание деликатное замечание авторов в названии – они называют свою работу «предложения для классификации и глоссария», т.е. не навязывают свое мнение всем специалистам и считают возможными коррекционные дополнения. Тем не менее авторы дали детальное описание и оценку разных форм нарушения движений. В классификации экстрапирамидных расстройств были выделены 2 части: часть 1 – классификация и номенклатура в описании экстрапирамидных расстройств; часть 2 – степень тяжести двигательных нарушений.
К числу очевидных достоинств этой классификации можно отнести: 1) выделение первичных форм как идиопатических спорадических, так и наследственных экстрапирамидных заболеваний; 2) выделение вторичных (симптоматических) форм, имеющих не дегенеративную природу, а определенно иную (часто известную) причину поражения мозга; 3) оценку степени тяжести проявлений двигательных нарушений и дефицита объема повседневной активности в условных количественных единицах (баллах); 4) рекомендации клинических приемов и определенных тестов для объективного выявления нарушений; 5) создание глоссария.
Со времени опубликования классификации прошло более 30 лет, однако за прошедшее с тех пор время ни за рубежом, ни в нашей стране этот доклад не послужил толчком к дискуссии специалистов-неврологов. В то же время не было ни одного выступления с критикой указанной классификации. К профессиональной чести членов авторской группы можно отнести тот факт, что они были самокритичны [6]. В предисловии к докладу этой комиссии сказано, что авторы «отдали приоритет симптому», т.е. рассматривают свою классификацию как симптоматическую. Можно полагать, что симптом представляет собой слишком узкий и изолированный элемент клинической картины, чтобы быть основанием для выработки подходов к нозологической диагностике. Чтобы убедиться в некорректности симптоматического подхода, достаточно рассмотреть один пример из этой классификации. Согласно предложенной в этой классификации структуре систематизации экстрапирамидных расстройств, одна из наиболее распространенных нозологических форм – болезнь Паркинсона – «расходится» по трем разным разделам классификации: гипокинезия – раздел IA, тремор – раздел – IB, ригидность – раздел IID1. Эта очевидная нелепость препятствует применению такой классификации для нозологической диагностики экстрапирамидных расстройств. Второе наше замечание: мы считаем некорректным объединение в общую группу «первичных» форм как при моносиндромных моносистемных, так и при полисиндромных мультисистемных вариантах экстрапирамидных расстройств. При таком подходе принятая авторами как важнейший «объединяющий» признак «первичность» затушевывает очевидные различия моно- и мультисистемных форм [8]. В последние десятилетия мультисистемные формы на практике для краткости именуют «синдром-плюс», что обозначает наличие в комбинированном синдроме признаков поражения не только экстрапирамидной, но и других систем. Например, к формам «паркинсонизм-плюс» относят прогрессирующий надъядерный паралич и мультисистемную атрофию [9, 11].
В недавние годы наряду с традиционными клиническими формами экстрапирамидных расстройств в эту группу были включены и некоторые другие заболевания с нарушениями движений. Это нашло отражение в «феноменологической» классификации нарушений движений, предложенной тремя выдающимися неврологами (S.Fahn, C.D.Marsden, J.Jankovic, 2011) (табл. 2). Однако она, на наш взгляд, не является в строгом понимании классификацией, а представляет собой только перечень экстрапирамидных расстройств. Она не может служить подспорьем в постановке нозологического диагноза.
Таблица 2. Классификация расстройств движений [10]
* В оригинальном тексте у авторов перечень терминов нарушений движений дан в соответствии с порядком алфавита английского языка. Этот порядок сохранен при переводе.
В свете изложенного выше мы считаем, что наиболее рациональна клиническая синдромологическая классификация, которая систематизирует экстрапирамидные расстройства на основании доминирующего клинического синдрома: паркинсонизма, тремора, мышечной дистонии, хореи, тика, миоклонии, атетоза, пароксизмальных форм дискинезии, других гиперкинезов. Практическому неврологу нужен путеводитель, «дорожная карта», чтобы не заблудиться в «дебрях» экстрапирамидных расстройств при постановке диагноза и по возможности правильно назвать заболевание, которое послано на грешную душу его больного.
Дорога к диагнозу экстрапирамидного расстройства бывает трудна и извилиста. Местами она напоминает топкое болото. И чтобы преодолеть это «болото», нужно знать, что в нем есть спасительные «твердые кочки». Чтобы преодолеть болото, нужно уметь прыгать с одной опорной кочки на другую, а чтобы не засосала трясина, нужно держать в руках спасительную слегу (длинную жердь). Вот такой «кочкой» и «слегой», которые помогают неврологу, мы видим клиническую синдромологическую классификацию экстрапирамидных расстройств [7, 8].
Системный подход к нозологическому диагнозу экстрапирамидных расстройств предполагает выделение в каждом из этих синдромов трех этиологических групп заболеваний:
Таблица 3. Клиническая классификация паркинсонизма
| Этиологическая категория | Основные нозологические формы | Код МКБ-10 |
| Первичный паркинсонизм | Болезнь Паркинсона | G20 |
| Юношеский паркинсонизм | G23.8 | |
| Вторичный (симптоматический) паркинсонизм | Лекарственный паркинсонизм | G21.1 |
| Посттравматический паркинсонизм | G21.2 | |
| Токсический паркинсонизм | G21.2 | |
| Постэнцефалитический паркинсонизм | G21.3 | |
| Паркинсонизм при гидроцефалии | G21.8/G22* | |
| Сосудистый паркинсонизм | G21.8/G22* | |
| Паркинсонизм при других дегенеративных заболеваниях ЦНС («паркинсонизм-плюс») | Преимущественно спорадические формы | |
| Мультисистемная атрофия | G23.2/G90.3 | |
| Прогрессирующий надъядерный паралич | G23.1 | |
| Болезнь диффузных телец Леви | G23.8 | |
| Кортикобазальная дегенерация | G23.8 | |
| Гемипаркинсонизм-гемиатрофия | G23.8 | |
| Болезнь Альцгеймера | G30†/G22* | |
| Болезнь Крейтцфельдта–Якоба | A81.0†/G22* | |
| Наследственные формы | ||
| Болезнь Гентингтона | G10 | |
| Спиноцеребеллярные дегенерации | G11.2 | |
| Нейродегенерация с накоплением железа | G23.0 | |
| Гепатолентикулярная дегенерация | Е83.0 | |
| Паллидарные дегенерации | G23.8 | |
| Семейная кальцификация базальных ганглиев | G23.8 | |
| Нейроакантоцитоз | G23.8 |
К этой группе принадлежат заболевания, которые могут быть наследственными (например, дистония, болезнь Гентингтона) или спорадическими (например, болезнь Паркинсона).
(спорадические и наследственные) заболевания ЦНС. В этих случаях помимо экстрапирамидной симптоматики выявляются признаки, связанные с поражением других систем ЦНС, например: пирамидный синдром, мозжечковая атаксия, вегетативная недостаточность. В целом заболевания этой группы представляют собой мультисистемные дегенерации. Место для заболевания с первичным полисиндромным и мультисистемным проявлением в клинической синдромологической классификации определяется дебютным и/или преобладающим синдромом. Часть из них имеет наследственный характер (например, спиноцеребеллярные дегенерации), другие – преимущественно спорадические (например, мультисистемная атрофия или прогрессирующий надъядерный паралич), но и здесь следует подчеркнуть условность границы между наследственными и спорадическими формами. К этой же группе мы относим и наследственные метаболические заболевания ЦНС (например, гепатолентикулярная дегенерация), при которых, в отличие от вышеупомянутых болезней, известен метаболический субстрат. Предлагаемую клиническую синдромологическую классификацию предлагаем рассмотреть на примере синдрома паркинсонизма (табл. 3).
По такому алгоритму в клинической синдромологической классификации представлены и другие экстрапирамидные синдромы [5, 6].