недостаточность биотинидазы код мкб 10
Недостаточность (дефицит) биотинидазы
Недостаточность (дефицит) биотинидазы – наследственное аутосомно-рецессивное заболевание из группы органических ацидурий, в основе которого лежит биотин-дефицитное состояние.
Известно, что биотинидаза – это энзим, участвующий в обмене биотина (или витамина Н, витамина B7, кофермента R) – водорастворимого витамина группы В, являющегося кофактором синтеза жирных кислот, распада аминокислот и глюконеогенеза. Биотин функционирует как коэнзим для четырех карбоксилаз. Биотинидаза содержится в клетках печени, почек, в сыворотке крови.
Заболевание обусловлено глубоким (менее 10% от нормального уровня активности фермента) или частичным (10–30% от средней активности в сыворотке) отсутствием фермента биотинидазы и характеризуется широким спектром клинических проявлений, которые включают в себя неврологическую симптоматику, кожные проявления, изменения со стороны органов зрения и слуха, нарушения иммунитета. Средний возраст дебюта заболевания — 3–6 месяцев, в редких случаях манифистирует и после 10 лет.
Решающее значение имеет ранняя диагностика, так как раннее начало лечения биотином в неонатальный период предоставляет возможность предотвратить формирование тяжелых клинических проявлений и умственной отсталости. При частичном дефиците биотинидазы и отсутствии лечения развиваются тяжелые поражения головного мозга и иммунитета, при глубокой недостаточности фермента высок риск смертельного исхода.
Ген биотинидазы BTD картирован на хромосоме 3p25 и состоит из четырех экзонов. По данным литературы, описано более 165 различных мутаций гена BTD.
По данным зарубежных исследований, распространенность недостаточности биотинидазы оценивается как 1:45 000 – 1:61 000 новорожденных. В Нидерландах (Wiltink R., 2016) распространенность дефицита биотинидазы составляет от 1:6100 до 1:8200 новорожденных.
В клинической картине заболевания у детей выделяют следующие ведущие синдромы:
Нарушения в раннем детском возрасте
Биохимические маркеры дефицита биотинидазы:
Признаки заболевания по МРТ/КТ:
Патогенетической терапией при дефиците биотинидазы является назначение биотина в дозе 5–30 мг/сутки постоянно.
Клинический случай
Мальчик был рожден от нормально протекавшей беременности, в срок с нормальными показателями веса и роста (50 см, 3250 г, оценка состояния при рождении по шкале Апгар 8–9 баллов). Находился на грудном вскармливании до 1 месяца, затем – на адаптированной молочной смеси. Периодически родители отмечали аллергические высыпания на щеках, с 2 месяцев появилась чешуйчатая сыпь на волосистой части головы, с 2,5 месяцев – постепенное облысение затылка, височных областей. С 3,5 месяцев появились судорожные приступы в виде подергиваний мышц конечностей с частотой до 6 раз в неделю, на фоне терапии конвулексом приступы судорог сохранялись. Наблюдался неврологом в связи с задержкой психомоторного развития: к 4,5 месяцам голову держал неуверенно, не переворачивался.
Несмотря на проводимую терапию, отмечалось ухудшение состояния в виде нарастания дыхательной недостаточности и формирования ателектаза в правом легком.
По данным КТ выявлены признаки генерализованной церебральной атрофии, подозрение на лейкодистрофию.
В связи с подозрением на обменную патологию был проведен анализ на спектр аминокислот и бета-окисления жирных кислот, по результатам которого выявлено: повышение концентрации в моче C5OH в крови снижение активности биотинидазы до 0,7 нмоль/мин/мл (норма: 4,4–15). Таким образом, ребенку был установлен диагноз «недостаточность биотинидазы». Назначена терапия биотином 20 мг/сутки.
На фоне терапии в течение недели редуцировались признаки дыхательной недостаточности, пневмония разрешилась на 10-й день, судорожные приступы не повторялись, что позволило снизить дозу антиконвульсантов до полной отмены. Показатели крови нормализовались.
В настоящее время мальчик (5,5 месяцев) уверенно держит голову, начал переворачиваться, сидит при поддержке, следит за предметами, улыбается.
Заключение
Таким образом, данный клинический случай подтверждает важность проведения дифференциальной диагностики наследственных болезней обмена (НБО) при наличии у ребенка сочетания воспалительных и неврологических изменений. Своевременная диагностика и, соответственно, раннее начало адекватной терапии при дефиците биотинидазы улучшают прогноз ребенка и позволяют достичь регресса уже развившихся осложнений.
Недостаточность других уточненных витаминов группы B
Рубрика МКБ-10: E53.8
Содержание
Определение и общие сведения [ править ]
Множественный дефицит карбоксилаз
Распространенность неизвестна. Нет никакого географического или этнического преобладания. Наследуется как аутосомно-рецессивный признак.
Этиология и патогенез [ править ]
Дефицит биотинидазы вызывается мутациями гена BTD (3p25), в результате чего снижается или отсутствует активность фермента BTD. Этот фермент перерабатывает свободный, несвязанный биотин, который необходим для функционирования множества биотин-зависимых обменных процессов. Определено более 150 мутации гена BTD, которые вызывают дефицит BTD.
Дефицит голокарбоксилазсинтазы вызывается мутациями гена HLCS (21q22.1), что приводит к снижению активности фермента HCS. Этот фермент играет важную роль в ковалентном связывании биотина с различными биотин-зависимыми карбоксилазами, которым требуется биотин для поддержания активности. Дефект связывания биотина приводит множественному дефициту карбоксилаз и накоплению различных аномальных органических кислот.
Клинические проявления [ править ]
Существуют две основные клинические формы множественного дефицита карбоксилаз в зависимости от их основной причины: дефицит биотинидазы (позднее начало), при которой, как правило, развиваются симптомы патологии в течение первых нескольких месяцев жизни и дефицит голокарбоксилазсинтазы (раннее начало), при которой симптомы развиваются в течение нескольких часов, дней или недель после рождения.
Пациенты с дефицитом голокарбоксилазсинтазы, как правило, обнаруживают плохой аппетит, рвоту, вялость, раздражительность, гипотонию и эксфолиативный дерматит. У также наблюдается кетолактический ацидоз, органическая ацидемию (-урия) и гипераммониемия. Без лечения патология может прогрессировать до неразрешимых судорог, отека мозга и комы. У детей часто отмечается задержка роста и развития.
Недостаточность других уточненных витаминов группы B: Диагностика [ править ]
Расстройство обнаруживается в ходе скрининга новорожденных, либо после манифестации клинических признаков и последующем обнаружении снижения активности соответствующих ферментов. Для дефицита голокарбоксилазсинтазы также харатерно обнаружение аномальных органических кислот. Молекулярное тестирование может подвердить диагноз.
Дифференциальный диагноз [ править ]
Другие отдельные дефициты карбоксилаз, изолированный дефицита алиментарного биотина, дефицита цинка и дефицит основных жирных кислот, дефекты цикла мочевины, сепсис и другие врожденные нарушения обмена веществ.
Недостаточность других уточненных витаминов группы B: Лечение [ править ]
Прогноз благоприятный при ранней диагностике и лечении.
Профилактика [ править ]
Прочее [ править ]
Дефицит пантотеновой кислоты
Дефицит пантотеновой кислоты в организме человека очень редок и наблюдается только в случаях тяжелого нарушения питания. Были описаны такие симптомы, как онемение, болезненное жжение и покалывание в ногах, во время Второй мировой войны у заключенных на Филиппинах, в Бирме, Японии, которые проходили при назначении пантотеновой кислоты.
Дефицит пантотеновой кислоты у человека был экспериментально индуцирован при совместном введении антагониста пантотеновой кислоты и обеднении рациона. Участники этого эксперимента жаловались на головную боль, усталость, бессонницу, кишечные расстройства, онемение и покалывание в руках и ногах. В более позднем исследовании участников перевели на диету, дефицитную по пантотеновой кислоте, при этом не возникли клинические признаки дефицита, хотя некоторые участники были вялыми и жаловались на усталость.
Адекватный уровень потребления для пантотеновой кислоты составляет 5 мг/сут. Верхний допустимый уровень потребления для пантотеновой кислоты составляет 15 мг/сут.
Пантетин доступен в качестве БАДа в Европе, Японии и России. Используется в качестве средства для снижения уровня холестерина.
Оральные контрацептивы, содержащие эстроген и прогестин, могут увеличить потребность в пантотеновой кислоте. Использование пантетина в комбинации с ингибитором ГМГ-КоА-редуктазы (статинов) или никотиновой кислотой может привести к дополнительному липидснижающему эффекту.
В исследованиях, проведенных в 80-е гг. XX в. по изучению пантотенового статуса беременных и содержания пантотеновой кислоты в материнском молоке, было показано, что концентрация пантотеновой кислоты в крови у беременных падает, а содержание пантотеновой кислоты в молоке коррелирует с ее концентрацией в крови.
Таким образом, во время беременности и кормления грудью необходимо повышенное потребление пантотеновой кислоты для обеспечения потребностей плода и грудного ребенка. Это может быть достигнуто путем более тщательного подбора продуктов с высоким содержанием питательных веществ. Также существуют витаминно-минеральные комплексы, в состав которых входит пантотенат кальция в безопасной и адекватной дозировке, позволяющей покрыть повышенную потребность в данном витамине у беременных и кормящих женщин.
Холин играет в печени критическую роль в формировании фосфолипидного компонента липопротеидов очень низкой плотности, обеспечивая высвобождение гепатоцитов из излишков триглицеридов, холестерина и жирных кислот и препятствуя тем самым жировой инфильтрации печени с последующим развитием окислительного стресса в гепатоцитах и их гибелью. Это свойство холина позволяет отнести его к липотропным факторам питания. Избыточное поступление ниацина с рационом может блокировать липотропные свойства холина.
Холин, участвуя в цикле однокарбоновых групп и трансформируясь в бетаин, обеспечивает весь спектр реакций метилирования на путях метаболизма во взаимосвязи с фолатом, витамином В12 и S-аденозилметионином, играя, в частности, ключевую роль в биотрансформации аминокислот, фосфолипидов, гормонов, карнитина и метилировании ДНК. Дефицит фолиевой кислоты, витамина В6, цинка, витамина В12 снижает возможности организма эффективно использовать холин.
Потребность в холине определена в количестве 500 мг в сутки.
Дефицит холина может возникать как при недостаточном поступлении лецитина и бетаина с пищей, так и в результате снижения (нарушения) его биосинтеза по различным, в том числе и генетически зависимым, причинам. К развитию относительного недостатка холина приводит избыточное поступление с пищей жиров и моно- и дисахаридов и дефицит белка. К лабораторным маркерам дефицита холина относят гипергомоцистеинемию на фоне сниженного количества липопротеидов очень низкой плотности и повышения активности АЛТ.
В результате длительного глубокого дефицита холина последовательно развиваются жировая инфильтрация печени, гепатит, фиброз и цирроз, а также может инициироваться канцерогенез в гепатоцитах в результате их окислительного повреждения, снижения репаративных процессов ДНК и нарушения регуляции апоптоза.
Содержание холина в рационе необходимо по возможности ограничивать (за счет снижения продуктов, богатых им) при генетическом дефекте флавинсодержащего монооксигеназного гена FM03, приводящем к развитию тех же симптомов, которые отмечаются при чрезмерном употреблении холина.
Источники (ссылки) [ править ]
Диагностика и лечение недостаточности биотинидазы у детей раннего возраста
Наследственные болезни обмена (НБО) — обширный класс моногенных заболеваний, обусловленных нарушениями различных белков, выполняющих разнообразные функции в метаболизме клетки. Выделяют более 600 нозологических форм НБО, которые, в свою очередь, подраз
Наследственные болезни обмена (НБО) — обширный класс моногенных заболеваний, обусловленных нарушениями различных белков, выполняющих разнообразные функции в метаболизме клетки. Выделяют более 600 нозологических форм НБО, которые, в свою очередь, подразделяют в зависимости от пораженного метаболического пути на 22 подкласса. Суммарная частота НБО в популяции достаточно высока и составляет 1 на 3–5 тыс. живых новорожденных [1, 3]. БСльшая часть НБО, протекающих с поражением нервной системы, манифестирует в раннем детском возрасте и носит неуклонно прогрессирующий характер, приводя к тяжелой инвалидности и дезадаптации больных. Клиническая диагностика этих заболеваний представляет значительные трудности. Они связаны с малой распространенностью отдельных нозологических форм, отсутствием специфических симптомов на ранних стадиях заболевания (плохая прибавка веса, срыгивания, беспокойство, нарушения сна, мышечная гипотония/гипертония, слабость зрительного контакта, задержка психомоторного развития), выраженным клиническим полиморфизмом, наличием атипичных форм [2, 3].
До постановки правильного диагноза дети, как правило, наблюдаются в стационарах по поводу различных заболеваний: перинатальное поражение нервной системы, последствия внутриутробной инфекции, эпилепсия. Основными критериями, позволяющими заподозрить наличие заболевания из группы НБО, являются: дебют в определенном возрасте, прогрессирующая задержка психомоторного развития; судороги, плохо поддающиеся коррекции с помощью базовой антиэпилептической терапии. Кроме того, при некоторых болезнях происходит вовлечение в патологический процесс других органов и систем (гепато- и спленомегалия, поражение кожи и ее придатков) [2, 3]. Приоритетную роль в их диагностике играют биохимические и молекулярно-генетические методы исследования.
На протяжении последних 200 лет, вплоть до 30-х гг. ХХ в., выявление наследственного заболевания было равносильно приговору для больного и его семьи, а эмпирические попытки лечения пациентов с этими тяжелейшими недугами являлись безуспешными. В начале 1930-х гг. впервые в мире невролог и генетик С. Н. Давиденков, основываясь на собственном клиническом опыте и достижениях экспериментальной генетики, указал на ошибочность мнения о неизлечимости НБО. Однако отсутствие сведений о патогенетических механизмах развития этих заболеваний в тот период ограничивало возможности разработки методов их лечения, и все подобные попытки, несмотря на правильные теоретические установки, оставались длительное время эмпирическими [1]. В настоящее время благодаря успехам генетики в целом и существенному прогрессу теоретической и практической медицины многие НБО лечатся с помощью ферментзаместительной или специфической терапии [1, 18]. В частности, речь идет о таких заболеваниях, как фенилкетонурия, лейциноз (болезнь «мочи с запахом кленового сиропа»), гликогенозы, лизосомные болезни накопления (болезнь Гоше, болезнь Фабри), гомоцистинурия, недостаточность биотинидазы (НБ) и др. [11]. Поэтому вопросы ранней диагностики, лечения и профилактики этих недугов имеют не только большое медицинское, но и социально-экономическое значение [5, 17].
Недостаточность биотинидазы
Недостаточность фермента ведет к нарушению освобождения биотина из пищевого белка и рециркуляции эндогенного биотина. Активность биотинидазы в головном мозге человека крайне низка, поэтому для нормального функционирования нейронов необходимо достаточное и постоянное поступление биотина через гематоэнцефалический барьер. Уменьшение концентрации биотина при НБ на первых стадиях заболевания приводит к снижению активности пируваткарбоксилазы, что вызывает накопление лактата в головном мозге. Этот локальный лактат-ацидоз обусловливает появление в первую очередь неврологических симптомов [12]. Кетоацидоз является признаком продолжительной недостаточности биотина в организме и может не выявляться на начальных этапах заболевания. Причиной нейросенсорной тугоухости является накопление органических кислот, биоцитина и более крупных биотинильных белков [19]. Снижение уровня протективных жирных кислот, возможно, является причиной появления алопеции и кожной сыпи [11].
Клинические проявления
НБ манифестирует в среднем в 3–5,5 мес жизни. В редких случаях заболевание дебютирует в подростковом возрасте или на первой неделе жизни. Степень тяжести клинических проявлений заболевания зависит от уровня активности биотинидазы. Так, высокая остаточная активность фермента (от 25 до 30% от нормы) характерна для юношеских форм НБ [21]. При тотальной НБ (активность фермента менее 5% от нормы) заболевание манифестирует в первые месяцы жизни.
В раннем возрасте наиболее частыми начальными симптомами являются судороги: миоклонические, генерализованные или парциальные [9]. Иногда основным клиническим симптомом служит мышечная гипотония. В ряде случаев НБ манифестирует задержкой психомоторного развития, нарушениями ритма дыхания (дыхание по типу Куссмауля, ларингеальный стридор, апноэ), себореей, атопическим дерматитом, гнездной и/или тотальной алопецией, персистирующими конъюнктивитами, нейросенсорной тугоухостью [4, 8, 10, 13, 20].
У большинства пациентов имеет место сочетание неврологических и кожных нарушений. При дебюте заболевания в подростковом возрасте начальными симптомами являются мышечная слабость, спастические парапарезы, зрительные нарушения (снижение зрения, появление скотом, атрофия зрительных нервов) [14, 15].
В результате проведенных нами исследований за 2 года удалось выявить трех пациентов с точно верифицированным диагнозом: недостаточность биотинидазы. Диагноз был подтвержден биохимическими и молекулярно-генетическими методами: тотальное снижение активности биотинидазы в сыворотке крови, метаболического ацидоза, повышение уровня специфических органических кислот и концентрации лактата в крови и ликворе. При проведении ДНК-диагностики было установлено, что два пациента являются гомозиготными по мутации G98d7i3, а один — компаунд-гетерозиготой по частым мутациям G98d7i3/R538C. Известно, что наличие этих мутаций в любом сочетании сопровождается ранней и тяжелой манифестацией НБ [7].
В качестве иллюстрации приводим выписку из истории болезни одного из наблюдавшихся нами больных.
Больной Л. К., 5 мес, находился в отделении психоневрологии и эпилепсии РДКБ. Поступил с жалобами на судороги по типу серийных инфантильных спазмов, задержку психомоторного развития, снижение слуха, повышенную потливость.
Из анамнеза известно, что ребенок родился от 2-й беременности, протекавшей на фоне угрозы прерывания на 7–8-й неделе, роды первые, на 39-й неделе беременности, самостоятельные, вес при рождении 2900 г, рост 51 см, оценка по шкале Апгар — 9–10 баллов. Выписан из роддома на 5-е сутки жизни в удовлетворительном состоянии. Перенесенные заболевания: отит, конъюнктивит. С рождения отмечался тремор ручек и подбородка. В 2 мес появились серийные, флексорные, симметричные инфантильные спазмы до 10 раз в сутки. Проводился подбор противосудорожной терапии без явного положительного эффекта. На фоне гормональной терапии синактеном депо судороги стали реже, но сохранялись до 5–7 раз в сутки.
При поступлении — состояние средней тяжести. Кожные покровы чистые, сухие. Видимые слизистые бледно-розовые. Волосы на голове тонкие и редкие. Подкожная жировая клетчатка развита избыточно. Развернута нижняя апертура грудной клетки. Носовое дыхание свободное. Границы сердца не увеличены. Сердечные тоны ритмичные, шумов нет. В легких дыхание пуэрильное, хрипов нет. Живот мягкий, безболезненный, доступен глубокой пальпации. Печень: + 1 см из-под края реберной дуги, селезенка не увеличена. Наружные половые органы развиты по мужскому типу.
Неврологический статус: общемозговых и менингеальных симптомов нет. Сознание ясное. Форма головы округлая с выступающими лобными буграми. Окружность головы – 42 см.
Глазные щели — OD=OS, взор фиксирует, кратковременно прослеживает, зрачки округлой формы, симметричные, фотореакция сохранена, лицо симметричное, снижение реакции на звуковые раздражители, нистагм установочный в крайних отведениях, глоточные и небные рефлексы живые, дисфония, саливация не усилена. Голову не держит, поворачивается на бок с трудом. Мышечная гипотония, с умеренным повышением мышечного тонуса в дистальных отделах конечностей. Сухожильные рефлексы симметричные, живые. Патологические рефлексы — с двух сторон. На болевые раздражители реагирует. Задержка редукции безусловных рефлексов: ладонно-ротовой (+), Переса (+), Галанта (+).
В сознании, на осмотр реагирует адекватно, дифференцирует окружающих, успокаивается на руках у мамы.
При клиническом анализе крови и мочи отклонений от нормы не выявлено.
Ультразвуковое исследование внутренних органов: без патологии.
Электроэнцефалографическое исследование: типичных данных о наличии локальной, диффузной и генерализованной эпилептиформной активности за время данного исследования получено не было.
Компьютерная аудиометрия: регистрируется снижение слуха по типу нейросенсорной тугоухости I–II степени.
Офтальмоскопия: частичная атрофия зрительных нервов.
 |
| Рисунок 1. МРТ головного мозга пациента Л. К., 5 мес |
МРТ головного мозга: на сериях сагиттальных, фронтальных и аксиальных МР-томограмм в режимах Т1 и Т2 на фоне резко расширенных субарахноидальных конвекситальных пространств лобных, теменных, затылочных и височных областей и базальных цистерн отмечается хроническая субдуральная гематома обоих лобных и верхних отделов височных областей. Признаков кровоизлияний в вещество головного мозга не выявлено. Заключение: признаки задержки миелинизации мозгового вещества. Хроническая субдуральная гематома указанной области (рис.1).
Обследование в лаборатории наследственных болезней обмена веществ ГУ Медико-генетического научного центра РАМН показало снижение активности биотинидазы — 0,56 (4,40–12 нмоль/мин/мл).
К проводимой антиэпилептической терапии добавлен биотин в дозе 10 мг/сут. Спустя 2 нед после назначения биотина состояние улучшилось: ребенок стал держать голову и переворачиваться со спины на живот, судороги купированы, отметилась тенденция к нормализации биохимических показателей.
При повторном поступлении через 3 мес на фоне специфической терапии отмечалась положительная динамика: отсутствие судорог, ребенок хорошо переворачивается со спины на живот и наоборот, дифференцирует окружающих, улучшились слух, зрение и рост волос на голове, активный лепет, уровень лактата и органических кислот в норме (табл.).
Клинические проявления у всех обследованных нами больных достаточно сходные: начало болезни в первом полугодии жизни, сочетание неврологических нарушений с поражением кожи и ее придатков (алопеция, дерматит), судороги, не поддающиеся коррекции базовыми антиэпилептическими препаратами.
После установления диагноза всем пациентам был назначен биотин в суточной дозе 10 мг/сут, продолжалось проведение противосудорожной терапии. Через 1,5–2 нед от начала лечения отмечался парадоксальный эффект в виде регресса выявляемых до лечения расстройств. Судороги не возобновлялись (за исключением пациента Л. С., у которого диагноз был верифицирован на поздних стадиях болезни). Больные дети стали постепенно приобретать психомоторные навыки и проявлять реакцию эмоционального оживления на осмотр: улыбка, способность зрительного сосредоточения на лицах, улучшился мышечный тонус, отмечен рост волос (рис. 2). Столь высокая эффективность специфического лечения может объясняться нормализацией метаболических процессов в организме, что совпадает с данными литературы [6].
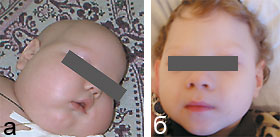 |
| Рисунок 2. Пациент Л. С. до терапии биотином (а) и после (б) |
Хотелось бы отметить, что от своевременной постановки диагноза и назначения специфической терапии зависит исход заболевания [16, 19]. Так, при ранней диагностике заболевания у больной П. Н. через 2 мес после начала патогенетической терапии психомоторное развитие соответствовало возрастной норме, тогда как у пациента Л. К. наблюдалась темповая задержка психомоторного развития. У одного из больных, несмотря на проведение специфического лечения, сформировался грубый неврологический дефицит (спастический тетрапарез, частичная атрофия зрительных нервов, нейросенсорная тугоухость, задержка психомоторного развития, редкие судороги), что может быть связано с наиболее ранним злокачественным течением заболевания (выраженный кетоацидоз и лактат-ацидоз) в исследуемой группе, а также его поздним выявлением (табл.).
Заключение
При выявлении у больного в первом полугодии жизни таких симптомов, как судороги, резистентные к проводимой антиэпилептической терапии, нарушения психомоторного развития, алопеция, дерматит, можно предположить наличие у пациента редкого недуга, относящегося к группе наследственных болезней обмена веществ, — недостаточности биотинидазы.
Применение специфической терапии биотином в дозе 10–30 мг/сут при данной патологии приводит к купированию судорог, регрессу неврологических расстройств, росту волос, восстановлению кислотно-основного равновесия и снижению уровня органических кислот в моче.
Исход заболевания зависит от своевременного установления правильного диагноза и назначения специфической терапии.
Литература
С. В. Михайлова
Е. Ю. Захарова, кандидат медицинских наук
Е. С. Ильина, кандидат медицинских наук
А. С. Петрухин, доктор медицинских наук, профессор
