пищевода барретта код по мкб
Другие болезни пищевода (K22)
Исключено: варикозное расширение вен пищевода (I85.-)
Исключен: врожденный кардиоспазм (Q39.5)
При необходимости идентифицировать причину используют дополнительный код внешних причин (класс XX).
Перепонка пищевода (приобретенная)
Исключено: травматическое прободение (торакальной части) пищевода (S27.8)
Диффузный спазм пищевода
Карман пищевода приобретенный
Исключен: врожденный дивертикул пищевода (Q39.6)
Исключены: язва Барретта (K22.1)
Пищеводное кровотечение БДУ
Алфавитные указатели МКБ-10
Внешние причины травм — термины в этом разделе представляют собой не медицинские диагнозы, а описание обстоятельств, при которых произошло событие (Класс XX. Внешние причины заболеваемости и смертности. Коды рубрик V01-Y98).
Лекарственные средства и химические вещества — таблица лекарственных средств и химических веществ, вызвавших отравление или другие неблагоприятные реакции.
В России Международная классификация болезней 10-го пересмотра (МКБ-10) принята как единый нормативный документ для учета заболеваемости, причин обращений населения в медицинские учреждения всех ведомств, причин смерти.
МКБ-10 внедрена в практику здравоохранения на всей территории РФ в 1999 году приказом Минздрава России от 27.05.97 г. №170
Выход в свет нового пересмотра (МКБ-11) планируется ВОЗ в 2022 году.
Сокращения и условные обозначения в Международой классификации болезней 10-го пересмотра
БДУ — без дополнительных уточнений.
НКДР — не классифицированный(ая)(ое) в других рубриках.
† — код основной болезни. Главный код в системе двойного кодирования, содержит информацию основной генерализованной болезни.
* — факультативный код. Дополнительный код в системе двойного кодирования, содержит информацию о проявлении основной генерализованной болезни в отдельном органе или области тела.
Синдром Барретта (K22.7)
Версия: Справочник заболеваний MedElement
14-16 октября, Алматы, «Атакент»
150 участников из 10 стран. Новинки рынка стоматологии. Цены от производителей
Общая информация
Краткое описание
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Этиология и патогенез
Эпидемиология
Признак распространенности: Редко
Факторы и группы риска
Клиническая картина
Клинические критерии диагностики
Cимптомы, течение
Диагностика
Дополнительные исследования: 24-часовое мониторирование рН в пищеводе, манометрия (сфинктры), импедансометрия. В диагностике ГЭРБ указанные методы имеют большое значение, занимая третье место после клинической оценки и эндоскопии.
Лабораторная диагностика
Патогномоничных лабораторных признаков пищевода Барретта нет.
Обязательные исследования: общий анализ крови.
Дополнительные исследования (проводятся для выявления осложнений и дифференциальной диагностики с другими заболеваниями): биохимический анализ крови (общий белок, глюкоза, АлАТ, АсАТ, амилаза, ЩФ).
В связи с тем, что у ряда лиц предполагается врожденная склонность к данной патологии, возможно проведение исследования генетических маркеров дисплазии пищевода (например р53) с целью выявления рисков.
Дифференциальный диагноз
Осложнения
Осложнениями являются развитие рака (частота до 1% в год) и возможные кровотечения. Прочие осложнения соответсвуют таковым при ГЭРБ.
Лечение
Соответствует принципам лечения ГЭРБ.
Целями лечения являются:
— подавление клинических проявлений ГЭРБ;
— заживление эрозивного эзофагита;
— профилактика аденокарциномы.
С целью профилактики аденокарциномы используется регулярная эндокскопия с биопсией. Частота процедур определяется степенью дисплазии. При высокой степени дисплазии показания к хирургическому лечению рассматриваются как можно скорее.
Пищевод Барретта
Рубрика МКБ-10: K22.7
Содержание
Определение и общие сведения [ править ]
В 1950 г. британский хирург Норман Барретт (Norman Barrett,) сообщил о наличии в нижней части пищевода цилиндрического эпителия рядом с язвами пищевода. Позднее он ввел громоздкий термин «нижняя часть пищевода, выстланная цилиндрическим эпителием». Впервые присутствие цилиндрического эпителия в пищеводе было отмечено ещё в 1904 г., однако заслуга Барретта заключается в том, что он указал на гастроэзофагеальный рефлюкс как ведущую причину эзофагита и ввёл термин «рефлюксный эзофагит». Барретт подчеркнул связь хронической язвы пищевода с цилиндрическим эпителием, похожим на таковой слизистой оболочки желудка. Он полагал, что у пациентов с врождённым коротким пищеводом и внутригрудным расположением желудка хроническая язва возникала в пределах желудочной слизистой оболочки.
Allison и Johnstone в 1953 г. предположили, что появление цилиндрического эпителия с пищеводе представляет приобретённое нарушение, развивающееся как следствие гастроэзофагеального рефлюкса. Более поздние исследования продемонстрировали, что цилиндрические клетки появляются не вследствие миграции из желудка, а возникают при метаплазии субмукозных полипотентных стволовых клеток в пищеводе, которые трансформируются в цилиндрические клетки после выраженного повреждения слизистой оболочки.
Наряду с терминами пищевод Барретта, синдром Барретта, «нижняя часть пищевода, выстланная цилиндрическим эпителием», цилиндрически выстланный пищевод, используются и другие названия данного состояния: как эпителий Барретта, истинный эпителий Барретта, метаплазия Барретта, специализированный цилиндрический эпителий, специализированная интестинальная метаплазия, желудочная интестинальная метаплазия неполного типа, а в европейской литературе также эндобрахиэзофагус.
Настоящее определение пищевода Барретта позволяет выявлять индивидуумов, которым показано эндоскопическое наблюдение и биопсия.
Пражская классификация метаплазии в пищеводе (2004)
Она использует две особенности: длину кругового сегмента метаплазированного эпителия (С) и общую длину (максимальная) (М) метаплазированного эпителия, начинающегося с верхних участков желудочных складок. Например, С3М5 означает, что круговой сегмент длиной 3 см и полная длина 5 см, включая 3 см циркулярного и 2 см подобного языку участка метаплазии. В новой классификации островки метаплазии не учитываются. Поэтому они должны быть описаны отдельно.
У пациентов с длительными симптомами ГЭРБ высока вероятность развития пищевода Барретта, поэтому им показано эндоскопическое исследование. Тяжесть симптомов рефлюкса коррелирует с риском развития аденокарциномы пищевода. Специфические критерии для отбора пациентов, подлежащих скринингу на пищевод Барретта, ещё не определены; выявление пациентов с бессимптомным течением пищевода Барретта остаётся сложной проблемой. Из-за наличия таких пациентов количество случаев аденокарцином, ассоциированных с пищеводом Барретта, в реальности может быть большим. Возможность бессимптомного течения пищевода Барретта обусловливает необходимость внимательной оценки дистальной части пищевода при проведении эндоскопического исследования по любым показаниям.
Этиология и патогенез [ править ]
Клинические проявления [ править ]
Пищевод Барретта: Диагностика [ править ]
Для постановки диагноза пищевода Барретта необходимо гистологическое исследование слизистой оболочки пищевода (выявление желудочной или кишечной метаплазии и дисплазии). Следовательно, при обнаружении во время эндоскопического исследования слизистой оболочки, напоминающей желудочную, необходима множественная биопсия.
Если зубчатая линия смещена вверх от желудочно-пищеводного перехода, то у пациента можно предположить наличие пищевода Барретта. Эрозивный эзофагит может визуально напоминать пищевод Барретта, что является ещё одной причиной, обусловливающей необходимость гистологического исследования.
Для улучшения диагностики применяют несколько методов эндоскопического окрашивания. Прижизненное окрашивание проводят с помощью раствора Люголя, толуидинового синего, индигокармина и метиленового синего. Лучшим методом, возможно, является окраска метиленовым синим, которая позволяет диагностировать пищевод Барретта при меньшем количестве биопсий.
Эндоскопия с увеличением улучшает диагностику пищевода Барретта за счёт улучшения изображения деталей слизистой оболочки и выявления наиболее подходящих для биопсии участков. Если эндоскопист подозревает наличие пищевода Барретта, необходимо проведение биопсии для выявления дисплазии. Степень дисплазии определяет интервал между повторными эндоскопиями, а такие патологические находки как узловые или язвенные изменения, требуют отдельной биопсии.
Выявление дисплазии любой степени при биопсии оправдывает повторное выполнение эндоскопического обследования с множесвенной биопсией области дисплазии для исключения аденокарциномы. Одним из признаков, на который следует обращать внимание, является бугристость слизистой оболочки. Этот признак увеличивает риск рака в 2,5 раза. При одинаковой степени узловых изменений слизистой оболочки пациенты с диффузной дисплазией высокой степени имеют риск развития рака в 3,7 раз больше, чем пациенты с фокальной дисплазией высокой степени.
Дифференциальный диагноз [ править ]
Пищевод Барретта: Лечение [ править ]
В настоящее время разработана следующая стратегия лечения больных с пищеводом Барретта.
• Устранение гастроэзофагеального рефлюкса.
• Предупреждение смерти от аденокарциномы пищевода.
• Предотвращение прогрессирования дисплазии.
• Лечение дисплазии высокой степени.
Необходимо отметить, что медикаментозная терапия может нивелировать симптомы рефлюкс-эзофагита у больных с пищеводом Барретта, но она неспособна вызвать регрессию метаплазии или уменьшить риск малигнизации.
Основные принципы эндоскопического наблюдения заключаются в следующем:
• При подозрении на пищевод Барретта и при резко выраженном рефлюкс-эзофагите вначале проводят интенсивную антирефлюксную терапию до достижения эпителизации эрозивноязвенных изменений. После этого берут биоптаты по всей длине замещённого сегмента и из всех визуально изменённых участков слизистой оболочки.
• При отсутствии дисплазии эндоскопическое исследование с биопсией повторяют 2 раза в год. Если признаков дисплазии нет, скрининговое исследование выполняют 1 раз в 3 года.
• При выявлении дисплазии низкой степени показаны продолжение медикаментозного лечения и выполнение эндоскопического исследования с биопсией дважды с 6-месячным интервалом, а затем ежегодно для выявления очага дисплазии высокой степени или рака.
• При выявлении дисплазии высокой степени необходимо повторить взятие биоптатов из 4 точек с интервалом в 1 см для выявления возможного очага аденокарциномы. Целесообразно выполнить эндосонографию с использованием датчика с частотой 20 МГц. Далее следует решить вопрос о малоинвазивном или хирургическом лечении в зависимости от общего статуса больного.
Для лечения пищевода Барретта применяются следующие эндоскопические методики.
• Мультиполярная электрокоагуляция слизистой оболочки.
• Коагуляция аргоновой плазмой.
• Эндоскопическая резекция слизистой оболочки.
Следует отметить, что, к сожалению, после эндоскопического лечения вероятность злокачественной трансформации сохраняется, так как никогда нельзя гарантировать удаление или деструкцию абсолютно всех клеток специализированной кишечной метаплазии. Восстановление плоского эпителия происходит поверх железистого эпителия, который может впоследствии малигнизироваться.
По мнению других исследователей, такой подход к лечению больных без очевидных доказательств малигнизации является чрезмерно агрессивным. Кроме того, от выявления дисплазии высокой степени до развития аденокарциномы нередко проходит от 3 до 5 лет, поэтому возможно проведение интенсивного эндоскопического наблюдения каждые 3-6 мес до тех пор, пока действительно не будет обнаружен рак.
В этот период для лечения дисплазии можно использовать малоинвазивные вмешательства, сопровождающиеся глубоким повреждением (фотодинамическая терапия, лазерная деструкция) или полным удалением участка слизистой оболочки в сочетании с интенсивной медикаментозной терапией. Наиболее радикальным эндоскопическим вмешательством на стадии дисплазии высокой степени и даже при раннем раке пищевода, безусловно, является резекция слизистой оболочки с последующим гистологическим исследованием удалённого препарата.
Профилактика [ править ]
Прочее [ править ]
Источники (ссылки) [ править ]
Пищевод Барретта: симптомы, прогноз, лечение
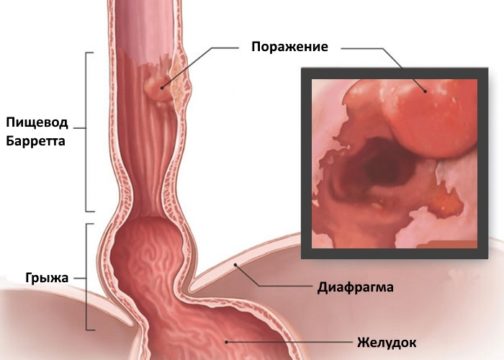
Пищевод Барретта (ПБ, синдром Барретта) — это изменение слизистой нижнего отдела пищевода по цилиндрическому типу любой длины, так называемая метаплазия. Эти изменения могут быть распознаны при эндоскопическом исследовании, после взятия биопсии из измененных участков и гистологического подтверждения.
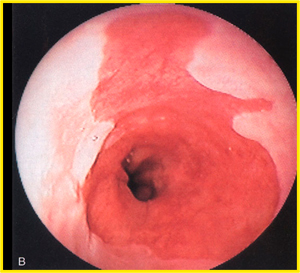 | 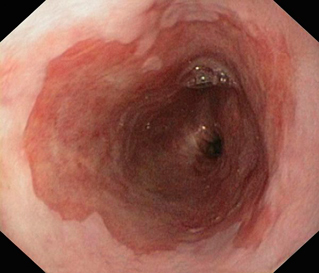 |
Причины и симптомы заболевания
Пищевод Барретта — это заболевание которое возникает в течении жизни, зачастую по причине следующих факторов:
Наиболее частые формы патологических изменений слизистой оболочки пищевода, которые могут привести к ПБ:
Основные жалобы пациентов и признаки пищевода Барретта
Не следует игнорировать перечисленные симптомы и откладывать поход к врачу, лучше профилактировать заболевание и начать лечение на ранних этапах, ведь процессы, происходящие на клеточном уровне не обратимы.
Диагностика пищевода Барретта
Основной и наиболее эффективный метод диагностики синдрома Барретта — эндоскопический. Его цель — получение биопсийного материала. При этом морфологическое исследование направлено на:
Для определения более точных границ измененной слизистой во время эндоскопического исследования используют хромоскопию, это окраска слизистой. Обычно используют раствор Люголя, при аллергии на йод — метиленовый синий, уксусную кислоту.
Лечение пищевода Барретта
Применяют следующие методы лечения пищевода Барретта:
Еще один применяемый и весьма радикальный метод — удаление нижней части пищевода.
Профилактика
Не существует специфической профилактики синдрома Барретта.
Предупредить его развитие помогает своевременная диагностика и лечение гастроэзофагеальной рефлюксной болезни, регулярные и своевременные посещения гастроэнтеролога, обследования и стойкое динамическое наблюдение.
После эффективного консервативного и хирургического лечения пищевода Барретта всем пациентам необходимо проходить ежегодное эндоскопическое обследование с биопсией эпителия.
Авторская публикация:
ВИНЦКОВСКАЯ АЛЕКСАНДРА ИГОРЕВНА
онколог, эндоскопист
НМИЦ онкологии им Н.Н. Петрова
Пищевода барретта код по мкб
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Случайный выбор
данная функция, случайным образом выбирает информацию для Вашего изучения,
запустите выбор нажав кнопку ниже
Случайный выбор
Обратная связь
Напишите нам
Сообщение об ошибке
Что улучшить?
| Авторы: | Королев М. П. Федотов Л. Е. Оглоблин А. Л. Антипова М. В. Климов А. В. Габдрахманова Л. А. 2017г. |
Enter the password to open this PDF file:
Полный текст статьи:
To view this video please enable JavaScript, and consider upgrading to a web browser that supports HTML5 video
Список литературы:
1. Баранская Е. К. Париет в современных схемах эрадикации инфекции Helicobacter pylori // Военномедицинский журнал.— 2001.— № 4.— С. 54–58.
2. Давыдов М. И., Тер-Ованесов М.Д., Стилиди И. С. Пищевод Барретта: от теоретических основ к практическим рекомендациям // Практическая онкология.— 2003.— № 4 (2): С. 109–118.
3. Ивашкин В. Т., Маев И. В., Трухманов А. С. Пищевод Барретта. Т. 2.— М., 2011.— С. 69–71.
4. Ивашкин В. Т., Маев И. В., Трухманов А. С. и др. Клинические рекомен- дации Российской Гастроэнтерологичесой Ассоциации по диагностике и лечению пищевода Барретта.— М., 2014.
5. Лазебник Л., Машарова А., Бордин Д. и др. Многоцентровое исследование “Эпидемиология гастроэзофагеальной рефлюксной болезни в Рос- сии” (МЭГРЕ): первые итоги // Экспериментальная и клиническая га- строэнтерология.— 2009.— № 6.— С. 4–11.
6. Машкин А. А., Хойрыш А. А., Ефанов А. В., Федосеева Н. Н. Применение эндоскопической аргонноплазменной коагуляции в лечении больных с острыми желудочнокишечными и пищеводными кровотечениями раз- личной этиологии: Пособие для врачей.— Тюмень, 2007. С. 7–11.
7. Осипенко М. Ф. и др. Пищевод Барретта — современное состояние про- блемы // Российский журнал гастроэнтерол., гепатол., колопроктол.— 2007.— № 4.— С. 11.
8. Пирогов С. С. Эндоскопические методики в уточняющей диагности- ке и лечении больных с пищеводом барретта: Автореф. дис. канд. мед. наук.— M., 2010.
9. Шептулин А. А. Париет — новый блокатор протонного насоса // Рос- сийский журнал гастроэнтерологии, гепатологии, колопроктологии.— 2000.— № 3.— С. 12–16.
10. Armstrong D., Marshall J. K., Chiba N. Canadian Association of Gastroenterology «GERD» Consensus Group. Canadian Consensus Conference on the management of gastroesophageal reflux disease in adults — update 2004 // Can. J. Gastroenterol.— 2005.— V. 19 (1).— Р. 15–35.
11. Avidan B., Sonnenberg A., Schnell T. G. et al. Hiatal hernia and acid reflux frequency predict presence and length of Barrett’s esophagus // Dig Dis Sci.— 2002.— V. 47.— P. 256–64.
12. Bennett C., Vakil N., Bergman J. et al. Consensus statements for management of Barrett’s dysplasia and early-stage esophageal adenocarcinoma, based on a Delphi process // Gastroenterology.— 2012.— V. 143.— P. 336–346
13. Bergman J., Fockens P. Management of HGIN in Barrett’s esophagus in book Barrett’s Esophagus and Esophageal Adenocarcinoma, Second Edition Edited By Prateek Sharma, Richard Sampliner // Blackwell Publishing Ltd., 2006.
14. Booth C. L., Thompson K. S. Barrett’s esophagus: A review of diagnostic criteria, clinical surveillance practices and new developments // J. Gastrointest. Oncol.— 2012, Sep.— V. 3 (3).— P. 232–242.
15. Cameron A. J., Carpenter H. A. Barrett’s esophagus, high-grade dysplasia and early adenocarcinoma: a pathological study // Am. J. Gastroenterol.— 1997.— V. 92.— P. 586–91.
16. Chandrasoma P., Wickramasinghe K., Ma Y. et al. Is intestinal metaplasia a necessary precursor lesion for adenocarcinomas of the distal esophagus, gastroesophageal junction and gastric cardia // Dis Esophagus.— 2007.— V. 20.— P. 36–41.
17. Chandrasoma P., Wijetunge S., DeMeester S. et al. Columnar-lined esophagus without intestinal metaplasia has no proven risk of adenocarcinoma // Am. J. Surg. Pathol.— 2012.— V. 36.— P. 1–7.
18. Chaves P., Crespo M., Ribeiro C. et al. Chromosomal analysis of Barrett’s cells: demonstration of instability and detection of the metaplastic lineage involved // Mod. Pathol.— 2007.— V. 20.— P. 788–796.
19. Conio M., Repici A., Cestari R. Endoscopic mucosal resection for highgrade dysplasia and intramucosal carcinoma in Barrett’s esophagus: an Italian experience // World J. Gastroenterol.— 2005.— V. 11.— P. 650–655.
20. Cromer W., Horbach S., Luhmann R. Relative efficacies of gastric proton pump inhibitors: their clinical and pharmacological basis // Pharmacology.— 1999.— V. 59.— 57–77.
21. Curvers W. L., Herrero L. A., Wallace M. B. Endoscopic trimodal imaging is more effective than standard endoscopy in identifying earlystage neoplasia in Barrett’s esophagus // Gastroenterology.— 2010.— V. 139.— P. 1106–1114.
22. Curvers W. L., Singh R., Song L. M. Endoscopic trimodal imaging for detection of early neoplasia in Barrett’s oesophagus: a multicentre feasibility study using highresolution endoscopy, autofluorescence imaging and narrow band imaging incorporated in one endoscopy system // Gut.— 2008.— V. 57.— P. 167–172.
23. Curvers W. L., ten Kate F. J., Krishnadath K. K. Lowgrade dysplasia in Barrett’s esophagus: overdiagnosed and underestimated // Am. J. Gastroenterol.— 2010.— V. 105.— P. 1523–1530.
24. Desai T. K., Krishnan K., Samala N. The incidence of oesophageal adenocarcinoma in nondysplastic Barrett’s oesophagus: a metaanalysis // Gut.— 2012.— V. 61.— P. 970–976.
25. Dunbar K. B., Spechler S. J. The risk of lymph-node metastases in patients with high-grade dysplasia or intramucosal carcinoma in Barrett’s esophagus: a systematic review // Am. J. Gastroenterol.— 2012.— V. 107.— P. 850–62.
26. Edelstein Z. R., Bronner M. P., Rosen S. N. et al. Risk factors for Barrett’s esophagus among patients with gastroesophageal reflux disease: a community clinic-based case-control study // Am. J. Gastroenterol.— 2009.— V. 104 — P. 834–842.
27. El-Serag H., Graham D. Routine polypectomy for colorectal polyps and ablation for Barrett’s esophagus are intellectually the same // Gastroenterology.— 2011.— V. 140 (2).— P. 386–388.
28. Endoscopic Classification Review Group. Update on the paris classification of superficial neoplastic lesions in the digestive tract // Endoscopy.— 2005.— V. 37.— P. 570–578.
29. Fitzgerald R., di Pietro M., Ragunath K. et al. British Society of gastroenterology guidelines on the diagnosis and management of Barrett’s oesophagus // Gut.— 2014.— V. 63.— P. 7–63
30. Hoshihara Y. Endoscopic diagnosis of Barrett esophagus — can Barrett esophagus be diagnosed by endoscopic observation alone // Nihon Naika Gakkai Zasshi.— 2000.— V. 89.— P. 85–90
31. Hvid-Jensen F., Pedersen L., Drewes A. M. Incidence of adenocarcinoma among patients with Barrett’s esophagus // N. Engl. J. Med.— 2011.— V. 365.— P. 1375–1383.
32. Jess T., Rungoe C., Peyrin-Biroulet L. Risk of colorectal cancer in patients with ulcerative colitis: a metaanalysis of populationbased cohort studies // Clin. Gastroenterol. Hepatol.— 2012.— V. 10.— P. 639–645.
33. Juhasz A., Mittal S. K., Lee T. H., et al. Prevalence of Barrett esophagus in first-degree relatives of patients with esophageal adenocarcinoma // J. Clin. Gastroenterol.— 2011. V. 45.— P. 867–871.
34. Langman M. J.S. Which PPI // Gut.— 2001.— V. 49.— P. 309–310.
35. Levine D. S., Blount P. L., Rudolph R. E. et al. Safety of a systematic endoscopic biopsy protocol in patients with Barrett’s esophagus // Am. J. Gastroenterol.— 2000.— V. 95.— P. 1152–1157
36. Liu W., Hahn H., Odze R. D. et al. Metaplastic esophageal columnar epithelium without goblet cells shows: DNA content abnormalities similar to goblet-cell containing epithelium // Am. J. Gastroenterol.— 2009.— V. 104.— P. 816–824.
37. Manner H., Rabenstein T., Pech O. Ablation of remaining Barrett’s epithelium after endoscopic resection: a randomized longterm followup study on argon plasma coagulation versus surveillance: APE study // Endoscopy.— 2014.— V. 46.— P. 6–12.
38. McClave S.A., Boyce H. W.J., Gottfried M. R. Early diagnosis of columnar- lined esophagus: a new endoscopic diagnostic criterion // Gastrointest. Endosc.— 1987.— V. 33.— P. 413–416.
39. McColl K.E.L., Kennerley P. Proton pump inhibitors — differences emerge in the hepatic metabolism // Digest Liver Dis.— 2002.— V. 34.— 461–467.
40. Pech O., Behrens A., May A. Longterm results and risk factor analysis for recurrence after curative endoscopic therapy in 349 patients with highgrade intraepithelial neoplasia and mucosal adenocarcinoma in Barrett’s oesophagus // Gut.— 2008.— V. 57.— P. 1200–1206.
41. Peters F. P., Brakenhoff K. P.M., Curvers W. L. Histologic evaluation of resection specimens obtained at 293 endoscopic resections in Barrett’s esophagus // Gastrointest. Endosc.— 2008.— V. 67.— P. 604–609.
42. Phoa K. N. Radiofrequency ablation vs endoscopic surveillance for patients with barrett esophagus and lowgrade dysplasia: A-randomized Clinical Trial // JAMA.— 2014.— V. 311 (12).— P. 1209–1217.
43. Pouw R. E., Wirths K., Eisendrath P. Efficacy of radiofrequency ablation combined with endoscopic resection for barrett’s esophagus with early neoplasia // Clin. Gastroenterol. Hepatol.— 2010.— V. 8.— P. 23–29.
44. Reid B. J., Haggitt R. C., Rubin C. E. et al. Observer variation in the diagnosis of dysplasia in Barrett’s esophagus // Hum. Pathol.— 1988.— V. 19.— P. 166–178.
45. Robinson M., Maton P. N., Rodriguez S. Effects of oral rabeprazole on oesophageal and gastric pH in patients with gastrooesophageal reflux disease // Aliment. Pharmacol. Ther.— 1997.— V. 11.— P. 973–980.
46. Schlemper R. J., Riddell R. H., Kato Y. et al. The Vienna classification of gastrointestinal epithelial neoplasia // Gut.— 2000.— V. 47.— P. 251–255.
47. Sharma P., Dent J., Armstrong D. et al. The development and validation of an endoscopic grading system for Barrett’s esophagus: the Prague C&M criteria // Gastroenterology.— 2006.— V. 131.— P. 1392–1399.
48. Sharma P., Morales T. G., Sampliner R. E. Short segment barrett’s esophagus — the need for standardization of the definition and of endoscopic criteria // Am. J. Gastroenterol.— 1998.— V. 93.— P. 1033–1036.
49. Sikkema M., De Jonge P. J.F., Steyerberg E. W. et al. Risk of esophageal adenocarcinoma and mortality in patient with Barrett’s esophagus: a systematic review and metaanalysis // Clin. Gastroenterol. Hepatol.— 2010.— V. 8.— P. 235–244.
50. Smith K. J., O’Brien S.M., Smithers B. M. et al. Interactions among smoking, obesity and symptoms of acid reflux in Barrett’s esophagus // Cancer Epidemiol. Biomarkers Prev.— 2005.— V. 14 (11 Pt. 1).— P. 2481–2486.
51. Spechler S. H., Sharma P., Souza R. et al. American Gastroenterological Association Medical Position Statement on the Management of Barrett’s Esophagus // Gastroenterology.— 2011.— V. 140 (3).— P. 1084–1091.
52. Spechler S. J. et al. American Gastroenterological Association medical position statement on the management of Barrett’s esophagus // Gastroenterology.— 2011.— V. 140 (3).— P. 1084.
53. Spechler S. J. Screening and surveillance of Barrett’s esophagus // Gastroenterol. Hepatol.— 2005.— Vol. 1 (2).— P. 91–93.
54. Stedman C. A.M., Barclay M. L. Comparison of the pharmacokinetics, acid suppression and efficacy of proton pump inhibitors // Aliment. Pharmacol. Ther.— 2000.— V. 14.— P. 963–978.
55. Theisen J., Nigro J. J., DeMeester T.R. et al. Chronology of the Barrett’s metaplasia dysplasia-carcinoma sequence // Dis Esophagus.— 2004.— V. 17.— P. 67–70.
56. Thomas T., Abrams K. R., De Caestecker J. S. et al. Metaanalysis: cancer risk in Barrett’s oesophagus // Aliment. Pharmacol. Ther.— 2007.— V. 26.— P. 1465– 1477.
57. Thomson A. B.R. Are the orally administered proton pump inhibitors equivalent & A-comparison of lansoprazole, omeprazole, pantoprazole and rabeprazole // Curr. Gastroenterol. Rep.— 2000.— V. 2.— P. 482–493.
58. Vahabzadeh B., Seetharam A. B., Cook M. B. et al. Validation of the Prague C&M criteria for the endoscopic grading of Barrett’s esophagus by gastroenterology trainees: a multicenter study // Gastrointest. Endosc.— 2012.— V. 75.— P. 236–241.
59. Vakil N., van Zanten S., Kahrilas P. et al. The Montreal definition and classification of gastroesophageal reflux disease: a global evidence-based consensus // Am. J. Gastroenterol.— 2006.— Vol. 101.— P. 1900–1920.
61. Van Laethem J. L., Jagodzinski R., Peny M. O. Argon plasma coagulation in the treatment of Barrett’s highgrade dysplasia and in situ adenocarcinoma // Endoscopy.— 2001.— V. 33.— P. 257–261.
62. Van Laethem J. L., Peny M. O., Salmon I. Intramucosal adenocarcinoma arising under squamous reepithelialisation of Barrett’s oesophagus // Gut.— 2000.— V. 46.— P. 574–577.
63. Wang K. K., Sampliner R. E. Diagnosis, surveillance and therapy of Barrett’s esophagus // Am. J. Gastroenterol.— 2008.— V. 103.— P. 788–797.
64. Warrington S., Baisley К., Boyce M. Effects of rabeprazole, 20 mg, or esomeprazole, 20 mg, on 24h intragastric pH and serum gastrin in healthy subjects // Aliment. Pharmacol. Ther.— 2002.— V. 16.— P. 1301–1307.
65. Williamson J. M.L., Almond L. M., Shepherd N. A., Barr H. Current management of Barrett’s oesophagus // Br. J. Hosp. Med. (Lond.) — 2012.— V. 73.— P. 271–277.
66. Yousef F., Cardwell C., Cantwell M. M. et al. The incidence of esophageal cancer and high-grade dysplasia in Barrett’s esophagus: a systematic review and metaanalysis // Am. J. Epidemiol.— 2008.— V.168.— P. 237–249.
67. Zhu W., Appelman H. D., Greenson J. K. et al. A histologically defined subset of high-grade dysplasia in Barrett mucosa is predictive of associated carcinoma // Am. J. Clin. Pathol.— 2009.— V. 132.— P. 94–100.