С чем реагирует fe2 so4
Железо — общая характеристика элемента, химические свойства железа и его соединений

Основные степени окисления — +2, +3
Простое вещество железо — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе.
Химические свойства простого вещества — железа:
Ржавление и горение в кислороде
1) На воздухе железо легко окисляется в присутствии влаги (ржавление):
Накалённая железная проволока горит в кислороде, образуя окалину — оксид железа (II, III):
2) При высокой температуре (700–900°C) железо реагирует с парами воды:
3) Железо реагирует с неметаллами при нагревании:
Fe + S – t° → FeS (600 °С)
4) В ряду напряжений стоит левее водорода, реагирует с разбавленными кислотами НСl и Н2SO4, при этом образуются соли железа(II) и выделяется водород:
Fe + 2HCl → FeCl2 + H2 (реакции проводятся без доступа воздуха, иначе Fe +2 постепенно переводится кислородом в Fe +3 )
В концентрированных кислотах–окислителях железо растворяется только при нагревании, оно сразу переходит в катион Fе 3+ :
(на холоде концентрированные азотная и серная кислоты пассивируют железо).
Железный гвоздь, погруженный в голубоватый раствор медного купороса, постепенно покрывается налетом красной металлической меди
5) Железо вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей.
Амфотерность железа проявляется только в концентрированных щелочах при кипячении:
и образуется осадок тетрагидроксоферрата(II) натрия.
Техническое железо — сплавы железа с углеродом: чугун содержит 2,06-6,67 % С, сталь 0,02-2,06 % С, часто присутствуют другие естественные примеси (S, Р, Si) и вводимые искусственно специальные добавки (Мn, Ni, Сr), что придает сплавам железа технически полезные свойства — твердость, термическую и коррозионную стойкость, ковкость и др.
Доменный процесс производства чугуна
Доменный процесс производства чугуна составляют следующие стадии:
а) подготовка (обжиг) сульфидных и карбонатных руд — перевод в оксидную руду:
б) сжигание кокса при горячем дутье:
в) восстановление оксидной руды угарным газом СО последовательно:
г) науглероживание железа (до 6,67 % С) и расплавление чугуна:
В чугуне всегда в виде зерен присутствуют цементит Fe2С и графит.
Производство стали
Передел чугуна в сталь проводится в специальных печах (конвертерных, мартеновских, электрических), отличающихся способом обогрева; температура процесса 1700-2000 °С. Продувание воздуха, обогащенного кислородом, приводит к выгоранию из чугуна избыточного углерода, а также серы, фосфора и кремния в виде оксидов. При этом оксиды либо улавливаются в виде отходящих газов (СО2, SО2), либо связываются в легко отделяемый шлак — смесь Са3(РO4)2 и СаSiO3. Для получения специальных сталей в печь вводят легирующие добавки других металлов.
Получение чистого железа в промышленности — электролиз раствора солей железа, например:
(существуют и другие специальные методы, в том числе восстановление оксидов железа водородом).
Чистое железо применяется в производстве специальных сплавов, при изготовлении сердечников электромагнитов и трансформаторов, чугун — в производстве литья и стали, сталь — как конструкционный и инструментальный материалы, в том числе износо-, жаро- и коррозионно-стойкие.
FеО + Н2 =Н2O + Fе (особо чистое) (350°С)
FеО + С(кокс) = Fе + СО (выше 1000 °С)
FеО + СО = Fе + СO2 (900°С)
Получение в лаборатории: термическое разложение соединений железа (II) без доступа воздуха:
FеСОз = FеО + СO2 (490-550 °С)
2(Fe II Fe2 III )O4 = 6FеО + O2 (выше 1538 °С)
(Fe II Fe2 III )O4 + 4Н2 = 4Н2O + 3Fе (особо чистое, 1000 °С)
Получение: сгорание железа (см.) на воздухе.
В природе — оксидная руда железа магнетит.
Оксид железа(III) Fе2О3. Амфотерный оксид с преобладанием основных свойств. Красно-коричневый, имеет ионное строение (Fе 3+ )2(O 2- )3. Термически устойчив до высоких температур. Не образуется при сгорании железа на воздухе. Не реагирует с водой, из раствора выпадает бурый аморфный гидрат Fе2O3 nН2О. Медленно реагирует с кислотами и щелочами. Восстанавливается монооксидом углерода, расплавленным железом. Сплавляется с оксидами других металлов и образует двойные оксиды — шпинели (технические продукты называются ферритами). Применяется как сырье при выплавке чугуна в доменном процессе, катализатор в производстве аммиака, компонент керамики, цветных цементов и минеральных красок, при термитной сварке стальных конструкций, как носитель звука и изображения на магнитных лентах, как полирующее средство для стали и стекла.
Уравнения важнейших реакций:
Получение в лаборатории — термическое разложение солей железа (III) на воздухе:
В природе — оксидные руды железа гематит Fе2O3 и лимонит Fе2O3 nН2O
Гидроксид железа (II) Fе(ОН)2. Амфотерный гидроксид с преобладанием основных свойств. Белый (иногда с зеленоватым оттенком), связи Fе — ОН преимущественно ковалентные. Термически неустойчив. Легко окисляется на воздухе, особенно во влажном состоянии (темнеет). Нерастворим в воде. Реагирует с разбавленными кислотами, концентрированными щелочами. Типичный восстановитель. Промежуточный продукт при ржавлении железа. Применяется в изготовлении активной массы железоникелевых аккумуляторов.
Уравнения важнейших реакций:
Получение: осаждение из раствора щелочами или гидратом аммиака в инертной атмосфере:
Метагидроксид железа FеО(ОН). Амфотерный гидроксид с преобладанием основных свойств. Светло-коричневый, связи Fе — О и Fе — ОН преимущественно ковалентные. При нагревании разлагается без плавления. Нерастворим в воде. Осаждается из раствора в виде бурого аморфного полигидрата Fе2O3 nН2O, который при выдерживании под разбавленным щелочным раствором или при высушивании переходит в FеО(ОН). Реагирует с кислотами, твердыми щелочами. Слабый окислитель и восстановитель. Спекается с Fе(ОН)2. Промежуточный продукт при ржавлении железа. Применяется как основа желтых минеральных красок и эмалей, поглотитель отходящих газов, катализатор в органическом синтезе.
Соединение состава Fе(ОН)3 не известно (не получено).
Уравнения важнейших реакций:
2FеО(ОН) + ЗН2 = 4Н2O+ 2Fе (особо чистое, 500—600 °С)
Получение: осаждение из раствора солей железа(Ш) гидрата Fе2О3 nН2O и его частичное обезвоживание (см. выше).
В природе — оксидная руда железа лимонит Fе2O3 nН2О и минерал гётит FеО(ОН).
Феррат калия К2FеО4. Оксосоль. Красно-фиолетовый, разлагается при сильном нагревании. Хорошо растворим в концентрированном растворе КОН, реагирует с кипящей водой, неустойчив в кислотной среде. Сильный окислитель.
Качественная реакция — образование красного осадка феррата бария. Применяется в синтезе ферритов — промышленно важных двойных оксидов железа (III) и других металлов.
Уравнения важнейших реакций:
FеО4 2- + Ва 2+ = ВаFеO4 (красн.)↓ (в конц. КОН)
Получение: образуется при окислении соединений железа, например метагидроксида FеО(ОН), бромной водой, а также при действии сильных окислителей (при спекании) на железо
и электролизе в растворе:
(феррат калия образуется на аноде).
Обнаружение ионов Fе 2+ и Fе 3+ в водном растворе проводят с помощью реактивов К3[Fе(СN)6] и К4[Fе(СN)6] соответственно; в обоих случаях выпадает синий продукт одинакового состава и строения, КFе III [Fе II (СN)6]. В лаборатории этот осадок называют берлинская лазурь, или турнбуллева синь:
Fе 2+ + К + + [Fе(СN)6] 3- = КFе III [Fе II (СN) 6]↓
Fе 3+ + К + + [Fе(СN)6] 4- = КFе III [Fе II (СN) 6]↓
Химические названия исходных реактивов и продукта реакций:
К3Fе III [Fе(СN) 6]- гексацианоферрат (III) калия
К4Fе III [Fе (СN) 6]- гексацианоферрат (II) калия
КFе III [Fе II (СN) 6]- гексацианоферрат (II) железа (Ш) калия
Fе 3+ + 6NСS — = [Fе(NСS)6] 3-
Этим реактивом (например, в виде соли КNСS) можно обнаружить даже следы железа (III) в водопроводной воде, если она проходит через железные трубы, покрытые изнутри ржавчиной.
Сульфат железа(III)
| Сульфат железа(III) | |
 | |
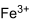   | |
| Общие | |
|---|---|
| Систематическое наименование | сульфат железа(III) |
| Традиционные названия | сернокислое железо(III), тетрасульфид(VI) железа(III) |
| Химическая формула | Fe2(SО4)3 |
| Эмпирическая формула | Fe2O12S3 |
| Физические свойства | |
| Состояние (ст. усл.) | безводный — светло-жёлтый порошок |
| Молярная масса | (безв.) 399.88 г/моль |
(пентагидрат) 489.96 г/моль
(безв.) растворим в разбавленной серной кислоте, ацетоне
15244-10-7 (для всех гидратов с формулой Fe2(SО4)3·nН2О (где n=1, 3, 4, 6, 7, 9, 10, 12)
Содержание
Физические свойства
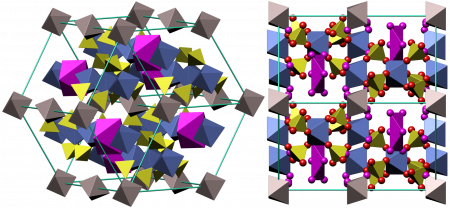
Безводный сульфат железа(III) — светло-желтые, парамагнитные, очень гигроскопичные кристаллы моноклинной сингонии, пространственная группа P21/m, параметры элементарной ячейки a = 0,8296 нм, b = 0,8515 нм,c = 1,160 нм, β = 90,5°, Z = 4. Есть данные, что безводный сульфат железа образовывает орторомбическую и гексагональную модификации. Растворим в воде и ацетоне, не растворяется в этаноле.
Из воды кристаллизуется в виде кристаллогидратов Fe2(SO4)3·n H2O, где n = 12, 10, 9, 7, 6, 3. Наиболее изученный кристаллогидрат — нонагидрат сульфата железа(III) Fe2(SO4)3·9H2O — жёлтые гексагональные кристаллы, параметры элементарной ячейки a = 1,085 нм, c = 1,703 нм, Z = 4. Хорошо растворяется в воде (440 г на 100 г воды) и этаноле, не растворяется в ацетоне. В водных растворах сульфат железа(III) из-за гидролиза приобретает красно-коричневый цвет.
При нагревании нонагидрат превращается при 98 °C в тетрагидрат, при 125 °C — в моногидрат и при 175 °C — в безводный Fe2(SO4)3, который выше 600 °C разлагается на Fe2O3 и SO3.
Нахождение в природе
Все перечисленные выше природные гидраты железа являются непрочными соединениями и в открытом состоянии быстро выветриваются.
Получение
В промышленности сульфат железа(III) получают прокаливанием пирита или марказита с NaCl на воздухе:
или растворяют оксид железа(III) в серной кислоте:
В лабораторной практике сульфат железа(III) можно получить из гидроокиси железа(III):
Препарат той же чистоты можно получить окислением сульфата железа(II) азотной кислотой:
также окисление можно провести кислородом или оксидом серы:

Концентрированные серная и азотная кислоты окисляют сульфид железа до сульфата железа(III):
Дисульфид железа можно окислить концентрированной серной кислотой:
Сульфат-аммоний железа(II) (соль Мора) также можно окислить дихроматом калия. Вследствие данной реакции выделятся сразу четыре сульфата — железа(III), хрома(III), аммиака и калия, и вода:

Сульфат железа(III) можно получить как один из продуктов термического разложения сульфата железа(II):
Ферраты с разбавленной серной кислотой восстанавливаются до сульфата железа(III):
Нагрев пентагидрат до температуры 70—175 °C получим безводный сульфат железа(III):
Сульфат железа(II) можно окислить таким экзотическим окислителем, как оксид ксенона(III):
Химические свойства
Сульфат железа(III) в водных растворах подвергается сильному гидролизу по катиону, при этом раствор окрашивается в красновато-коричневый цвет:


Горячая вода или пар разлагают сульфат железа(III):
Безводный сульфат железа(III) при нагревании разлагается:

Растворы щелочей разлагают сульфат железа(III), продукты реакции зависят от концентрации щёлочи:

Если с щёлочью взаимодействует эквимолярный раствор сульфатов железа(III) и железа(II), то в результате получится сложный оксид железа:
Активные металлы (такие как магний, цинк, кадмий, железо) восстанавливают сульфат железа(III):
Некоторые сульфиды металлов (например, меди, кальция, олова, свинца, ртути) в водном растворе восстанавливают сульфат железа(III):
С растворимыми солями ортофосфорной кислоты образует нерастворимый фосфат железа(III) (гетерозит):
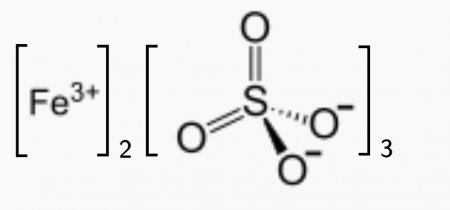
Сульфат железа (III)
| Сульфат железа (III) | |
|---|---|
 | |
| Систематическое наименование | сульфат железа (III) |
| Традиционные названия | сернокислое железо (III), тетрасульфид (VI) железа (III) |
| Хим. формула | Fe2(SO4)3 |
| Рац. формула | Fe2O12S3 |
| Состояние | безводный — светло-жёлтый порошок |
| Молярная масса | |
| • разложения | 600 |
| Мол. теплоёмк. | 271,75 Дж/(моль·К) |
| Энтальпия | |
| • образования | −2580 кДж/моль |
| Растворимость | |
| • в воде | (безв.) растворим(нонагидрат) 440 г/100 мл |
| • в этаноле | (нонагидрат) растворим |
| Рег. номер CAS | 15244-10-7 (для всех гидратов с формулой Fe2(SO4)3·nH2O (где n=1, 3, 4, 6, 7, 9, 10, 12) |
| RTECS | NO8505000 |
| ChEBI | 53438 |
| ChemSpider | 23211 и 21493902 |
| ЛД50 | (крысы, орально) 500 мг/кг |
| Пиктограммы ECB |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Содержание
Физические свойства
Безводный сульфат железа (III) — светло-жёлтые парамагнитные очень гигроскопичные кристаллы моноклинной сингонии, пространственная группа P21/m, параметры элементарной ячейки a = 0,8296 нм, b = 0,8515 нм, c = 1,160 нм, β = 90,5°, Z = 4. Есть данные, что безводный сульфат железа образовывает орторомбическую и гексагональную модификации. Растворим в воде, трудно растворим в этаноле.
Из воды кристаллизуется в виде кристаллогидратов Fe2(SO4)3·n H2O, где n = 12, 10, 9, 7, 6, 4, 3, 1. Наиболее изученный кристаллогидрат — нонагидрат сульфата железа (III) Fe2(SO4)3·9H2O — жёлтые гексагональные кристаллы, параметры элементарной ячейки a = 1,085 нм, c = 1,703 нм, Z = 4. Хорошо растворяется в воде (440 г на 100 г воды). В водных растворах сульфат железа(III) из-за гидролиза приобретает красно-коричневый цвет.
При нагревании нонагидрат превращается при 98 °C в тетрагидрат, при 125 °C — в моногидрат и при 175 °C — в безводный Fe2(SO4)3, который выше 600 °C разлагается на Fe2O3 и SO3.
Нахождение в природе
Все перечисленные выше природные гидраты железа на поверхности Земли нестабильны. Но их запасы постоянно пополняются благодаря окислению других минералов (в основном пирита и марказита).
Сульфат железа и ярозит были обнаружены двумя марсоходами: «Спирит» и «Оппортьюнити». Эти вещества являются признаком сильных окислительных условий на поверхности Марса. В мае 2009 года «Спирит» застрял, когда ехал по мягкому грунту планеты и наехал на залежи сульфата железа, скрытые под слоем обычного грунта. Вследствие того, что сульфат железа имеет очень низкую плотность, марсоход застрял настолько глубоко, что часть его корпуса коснулась поверхности планеты.
Получение
В промышленности сульфат железа (III) получают прокаливанием пирита или марказита с NaCl на воздухе:
или растворяют оксид железа (III) в серной кислоте:
В лабораторной практике сульфат железа (III) можно получить из гидроокиси железа (III):
Препарат той же чистоты можно получить окислением сульфата железа (II) азотной кислотой:
также окисление можно провести кислородом или оксидом серы:
Концентрированные серная и азотная кислоты окисляют сульфид железа до сульфата железа (III):
Дисульфид железа можно окислить концентрированной серной кислотой:
Сульфат-аммоний железа (II) (соль Мора) также можно окислить дихроматом калия. Вследствие данной реакции выделятся сразу четыре сульфата — железа (III), хрома (III), аммония и калия, и вода:
Сульфат железа (III) можно получить как один из продуктов термического разложения сульфата железа (II):
Ферраты с разбавленной серной кислотой восстанавливаются до сульфата железа (III):
При нагревании пентагидрата до температуры 70—175 °C получается безводный сульфат железа (III):
Сульфат железа (II) можно окислить триоксидом ксенона:
Химические свойства
Сульфат железа (III) в водных растворах подвергается сильному гидролизу по катиону, при этом раствор окрашивается в красновато-коричневый цвет:
Горячая вода или пар разлагают сульфат железа (III):
Безводный сульфат железа (III) при нагревании разлагается:
Растворы щелочей разлагают сульфат железа (III), продукты реакции зависят от концентрации щёлочи:
Если с щёлочью взаимодействует эквимолярный раствор сульфатов железа (III) и железа (II), то в результате получится сложный оксид железа:
Активные металлы (такие как магний, цинк, кадмий, железо) восстанавливают сульфат железа (III):
Некоторые сульфиды металлов (например, меди, кальция, олова, свинца, ртути) в водном растворе восстанавливают сульфат железа (III):
С растворимыми солями ортофосфорной кислоты образует нерастворимый фосфат железа (III) (гетерозит):
- С чем сделать пюре на ужин гарнир
- hamachi the windows installer service could not be accessed что делать