С чем реагирует кислота фосфорная кислота
С чем реагирует кислота фосфорная кислота
Степень окисления фосфора равна +5.
Оксид фосфора (V), взаимодействуя с водой, образует метафосфорную кислоту, последняя при кипячении переходит в ортофосфорную, при нагревании ортофосфорной кислоты образуется пирофосфорная кислота.
Метафосфорная кислота HPO3 неустойчива и в чистом виде не выделена, так же как не выделены из растворов её соли. Существует в виде полимеров. Относится к сильным кислотам, ей не свойственны окислительные и восстановительные свойства.
Ортофосфорная кислота
Среди оксокислот фосфора наибольшее значение имеет ортофосфорная кислота Н3РО4, она является наиболее устойчивой из всех кислот фосфора.
Строение молекулы
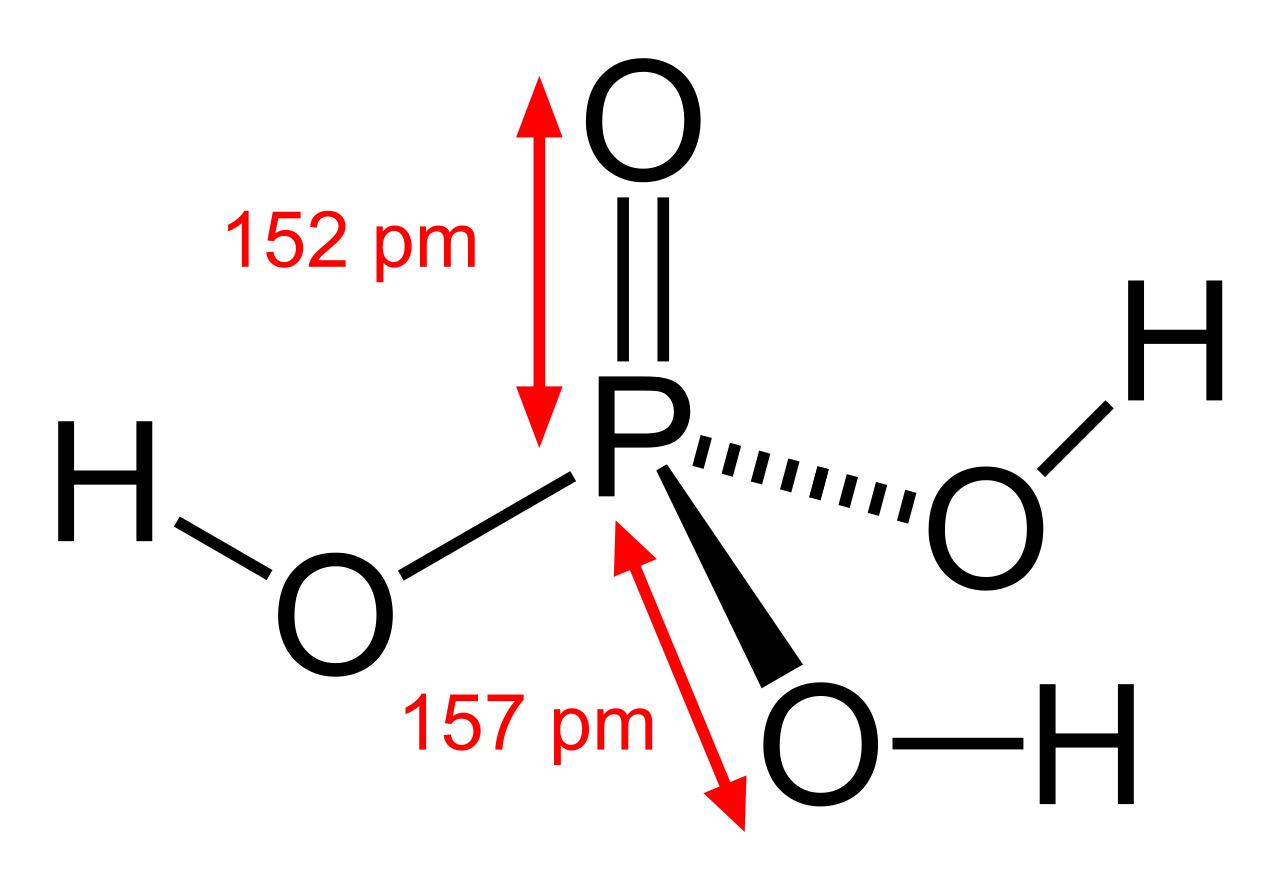
В газовой фазе молекула имеет форму тетраэдра с атомом фосфора в центре, в вершинах тетраэдра находятся атом кислорода и три гидроксогруппы. Поэтому фосфорная кислота является трехосновной.
В кристаллическом виде она построена из молекул РО(ОН)3, связанных водородными связями в двухмерные слои. Твердую фосфорную кислоту получить очень сложно: благодаря большому числу водородных связей концентрирование растворов приводит к образованию вязких сиропов, которые кристаллизуются лишь со временем.
Физические свойства
Химические свойства
При комнатной температуре довольно инертна, при нагревании проявляет свойства кислот, относится к кислотам средней силы.
Реагирует с металлами, стоящими в ряду напряжений металлов до водорода:
С оксидами металлов:
Не проявляет ни окислительных, ни восстановительных свойств.
Получение
Термический способ получения фосфорной кислоты основан на окислении элементарного фосфора в избытке воздуха с последующей гидратацией и образующегося оксида фосфора (V) и конденсацией фосфорной кислоты:
Также ортофосфорную кислоту получают при переработке апатитов:
Фосфорная кислота: получение и свойства
Строение молекулы и физические свойства
Фосфор в степени окисления +5 образует несколько кислот: орто-фосфорную H3PO4, мета-фосфорную HPO3, пиро-фосфорную H4P2O7.
Фосфорная кислота H3PO4 – это кислота средней силы, трехосновная, прочная и нелетучая. При обычных условиях фосфорная кислота – твердое вещество, хорошо растворимое в воде и гигроскопичное.
Валентность фосфора в фосфорной кислоте равна V.
При температуре выше +213 °C орто-фосфорная кислота переходит в пирофосфорную H4P2O7.
При взаимодействии высшего оксида фосфора с водой на холоде образуется метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу.
Способы получения
Наибольшее практическое значение из фосфорных кислот имеет ортофосфорная кислота.
1. Получить орто-фосфорную кислоту можно взаимодействием оксида фосфора (V) с водой:
Промышленный способ получения фосфорной кислоты обработка фосфорита концентрированной серной кислотой:
3. Фосфорную кислоту также можно получить жестким окислением соединений фосфора в водном растворе в присутствии кислот.
Химические свойства
1. Фосфорная кислота частично и ступенчато диссоциирует в водном растворе.
HPO4 2– ⇄ H + + PO4 3–
2. Фосфорная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Еще пример : при взаимодействии фосфорной кислоты с гидроксидом калия образуются фосфаты, гидрофосфаты или дигидрофосфаты:
3. Фосфорная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также фосфорная кислота вступает в обменные реакции с солями.
4. При нагревании H3PO4 до 200°С происходит отщепление от нее молекулы воды с образованием пирофосфорной кислоты H2P2O7:
5. Фосфорная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Фосфорная кислота взаимодействует также с аммиаком с образованием солей аммония:
7. Качественная реакция на фосфат-ионы и фосфорную кислоту — взаимодействие с нитратом серебра. При этом образуется ярко-желтый осадок фосфата серебра:
Видеоопыт взаимодействия фосфата натрия и нитрата серебра в растворе (качественная реакция на фосфат-ион) можно посмотреть здесь.
Ортофосфорная кислота. Свойства и применение ортофосфорной кислоты
Роберт Бойль жил в 17-ом столетии. Тогда же открыта ортофосфорная кислота. Связанны ли эти факты? Да. Новое соединение обнаружил именно Бойль.
Свойства ортофосфорной кислоты
Формула ортофосфорной кислоты: — H3PO4. Приставка «орто» указывает на то, что кислота кислородная и, что в ней содержится наибольшее число гидроксильных групп.
В пара-соединениях заместители максимально удалены, а в орто – соседи. Но, это информация, так сказать, для ознакомления. Вернемся к обсуждению героини статьи.
Внешне ортофосфорная кислота – кристаллы ромбической формы. Они бесцветны и плавятся при 42-ух градусах Цельсия.
Если кристаллизовать полугидрат, получатся гексагональные призмы. Увидеть их можно, взяв раствор ортофосфорной кислоты и охладив его.
С водой кислота смешивается в любых соотношениях. Причина кроется в системе связей с жидкостью.
Молекулы героини статьи охотно стыкуются с ней, отсоединяясь, при этом, друг от друга.
То есть, в воде соединение распадается на массу отдельных фрагментов, создавших водородные связи со структурными элементами жидкости.
Если же рассматривать строение чистой ортофосфорной кислоты, то она представляет макромолекулу. Отдельные молекулы в ней связаны между собой.
Водородные связи прочны и надежны. Это сказывается на физических свойствах.
Монолит плохо проводит электричество, почти не способен к диффузии, то есть, проникновению в другие вещества.
Если чистая ортофосфорная кислота плавится, то жидкость получается вязкой и маслянистой, — молекулы соединения не хотят отпускать друг друга.
В растворе героиня статьи может быть электролитом средней силы. Дойти до высшей отметки не дает внутреннее строение молекул ортофосфорного соединения.
Длины связей между атомами в нем нетипичны. Согласно формуле, между фосфором и кислородом образуется двойная стыковка.
Но, высчитывая длину связи, получаем 1,74, то есть, число, не кратное двум. Длина одинарной связи между кислородом и водородом, напротив, больше положенного, — 1,3 вместо 1-го.
Получается, электронная плотность связи P=O частично распределяется по другим связям.
Отсутствие резкого различия в длинах связей приводит к нестандартному строению молекул. Их форма приближена к тетраэдрам, то есть, пирамидальна.
Вследствие такого строения реакция ортофосфорной кислоты с большинством веществ невозможна, протекает медленно.
Добыча ортофосфорной кислоты
Но, чаще, берут конденсированные фосфаты. В них больше одного атома фосфора.
Фосфаты, в свою очередь, добывают из фосфоритов. Это природное сырье, а точнее, группа минералов.
Пример получения героини статьи разберем на соединении фосфата кальция и сульфата водорода. Запись реакции такова: — Ca3(PO4)2 + 3H2SO4 à 3CaSO4 + 2H3PO4.
Для получения последней, достаточно гидролиза, то есть, взаимодействия с водой. Реакция такова: — PCL5 + 4H2O à H3PO4 + 5HCl.
Взаимодействовать с водой заставляют, так же, оксид фосфора. Его получают, сжигая 15-ый элемент в присутствии кислорода.
Применение ортофосфорной кислоты
Удаление ортофосфорной кислоты из жизни человека может вызвать коллапс. Соединение используется, как минимум, в семи сферах промышленности.
В пищевой отрасли кислоту называют Е338. Обработка ортофосфорной кислотой продуктов фиксирует их цвет, не позволяет изменить его. Во многом, это вызвано тем, что добавка приостанавливает процессы окисления.
Е338 относится к антиоксидантам, в отличие от многих ешек, полезна, как и сам фосфор. В организме он входит в фосфотазы.
Это ферменты, без коих клетки не смогут нормально функционировать. Нормальный вкус без Е338 тоже получается не всегда.
Добавка придает блюдам приятные кислинку, или остроту. Конкретный вкус зависит от количества кислоты в продукте и ее концентрации.
Теперь, вспоминаем острые и кисловатые блюда. На первом месте, пожалуй, газировка. По интернету ходят страшилки о гвозде, который может разъесть «Кока-Кола», если тот полежит в ней неделю.
Страшилка не из разряда фантастики. Однако, желудочный сок способен сделать тоже самое, причем, быстрее.
Ортофосфорная кислота с металлами реагирует, как и большинство кислот.
Именно поэтому, за длительный срок, соединение может растворить гвоздь и, именно поэтому, используется в очищающих смесях.
Имеются в виду средства для снятия ржавчины, полировки металлических поверхностей.
Ортофосфорная кислота от ржавчины чаще всего используется в быту, при реставрации предметов.
Они облегчают отделение от руды пустой породы и снижают температуру плавления. Соответственно, флюсы нужны при пайке.
Находится ортофосфорная кислота и в аптеке. Вещество входит в состав средств от мочекаменной болезни.
К тому же, героиню статьи используют стоматологи. Им реактив нужен для протравки эмали перед пломбированием, а так же, обработки внутренней части коронок.
Кислота частично растворяет металлическую основу протезов. В ней появляются поры, в которые попадает скрепляющий цемент. В итоге, соединение коронки с зубом получается максимально прочным.
Ортофосфорная кислота входит в состав фреонов, а они, как известно, — основа морозильных установок.
Основой героиня статьи является и для многих косметических средств. В них кислота стабилизирует химические связи между составными элементами.
Аналогичную функцию соединение выполняет в моющих средствах из разряда бытовой химии.
Добавим к списку ортофосфорную кислоту в гидрожидкостях для авиационной технике, в удобрениях, даже в молекулярных исследованиях биологов.
Последние, используют реагент для осветления срезов тканей, рассматриваемых под микроскопом.
Не стоит забывать и о том, что фосфор светится в темноте, а значит, и ортофосфорная кислота способна раскрасить серые будни. Сколько за это придется заплатить? Ответ в финальной главе.
Цена ортофосфорной кислоты
Купить ортофосфорную кислоту, как правило, предлагают в растворах. Основная концентрация – 85%. Разливают в канистры по 25,30, 32, 40 литров.
Ценник выставляется за кило. В среднем, это 80-110 рублей. Максимальный ценник достигает 150 рублей за литр. Минимальный запрос продавцов равен 43-ем рублям.
Стоит учесть, что стоимость зависит от ГОСТа. Ортофосфорная кислота 6552-80 чистая, подходит для пищевой промышленности, реактивов, косметической отрасли.
Но, есть и техническая жидкость. Она желтовата, что указывает на наличие загрязнений. ГОСТ технической кислоты – 10678-76.
В рознице ортофосфорную кислоту продают в маленьких тюбиках. Так, 50 миллилитров для пайки стоят около 100 рублей.
Остальная продукция содержит много дополнительных элементов. В сельскохозяйственных удобрениях, к примеру, кроме ортофосфорной кислоты присутствует комплекс других минералов.
Поэтому, ценник зависит от их количества, характера. В «игру» вступают наценки раскрученных производителей.
Поэтому, об объективной стоимости ортофосфорного соединения судят лишь по объявлениям об оптовых закупках концентрированного раствора реагента.
Фосфорная кислота [H3PO4]: Структура | Свойства | Применение
В чистом виде фосфорная кислота представляет собой бесцветное твердое вещество. В менее концентрированном виде это вязкая жидкость без запаха с плотностью 1,885 г/мл. Обычно она нелетучая и нетоксична, но 85-процентный раствор по-прежнему может повредить глаза и вызвать сильное раздражение кожи.
Давайте копнем глубже и выясним, как образуется фосфорная кислота, как она выглядит на молекулярном уровне, каковы ее физические и химические свойства и где она используется.
Профиль фосфорной кислоты
Молярная масса: 97,994 г/моль
Внешний вид: густая бесцветная жидкость.
Точка кипения: 212 °C
Точка плавления: 42,35 °C (кристаллического твердого вещества)
Динамическая вязкость: от 2,4 до 9,4 сантипуаз (85% водный раствор).
Плотность: 1,83 г / см 3 (твердое вещество); 1,68 г / см 3 (85% водный раствор при 25 °C)
Структура
Соединение H3PO4 имеет в общей сложности 32 валентных электрона. Поскольку фосфор является наименее электроотрицательным, он помещается в центре. Атомы водорода присоединяются к внешней стороне атомов кислорода, образуя он-Группы.
В этой структуре каждый атом имеет полную внешнюю оболочку: атомы фосфора и кислорода имеют восемь валентных электронов, а атомы водорода имеют вокруг себя два валентных электрона.
В структуре все еще есть 32 валентных электрона, и каждый атом имеет формальный заряд, равный нулю. Таким образом, это наиболее вероятная или вероятная структура Льюиса для H3PO4.
Соединение содержит 3 одинарные связи ОН, 3 одинарные связи PO и 1 двойную связь P = O. Каждая одинарная связь является сигма-связью, а двойная связь состоит из сигма-связи и пи-связи.
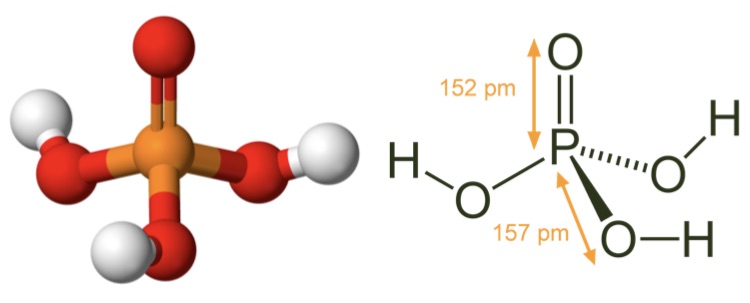
Фосфорная кислота: шарообразная модель и размеры структурной формулы
Молекулярная геометрия PO (OH)3 является тетраэдрической, а кристаллическая структура-моноклинной. А поскольку распределение зарядов на центральных атомах асимметрично, то молекула считается полярной.
Последние достижения в области нанотехнологий, включая методы поглощения рентгеновских лучей вблизи краев и методы рассеяния рентгеновских лучей под большим углом, позволили ученым точно определить структуру фосфорной кислоты. Расстояние связи P=O в структуре близко к 152 пикометрам, и расстояния P=O-O были уточнены до 309 пикометров, с углом связи близким к тетраэдрическому.
Как она производится?
Фосфорная кислота может быть синтезирована либо мокрым способом, либо термическим способом.
В последнем в качестве сырья используются воздух, вода и элементарный фосфор. Он включает в себя три важных этапа: сгорание, увлажнение и запотевание. Вот как это происходит:
Во-первых, жидкий элементарный фосфор сжигается в камере сгорания при высоких температурах в диапазоне от 1650 до 2760 °C. Эта реакция окисления происходит в окружающем воздухе и производит пятиокись фосфора.
Затем продукт гидратируют водой с образованием сильной фосфорной кислоты (в жидком состоянии).
На последнем этапе для удаления фосфорно-кислотного тумана из потока дымовых газов используются высоконапорные каплеуловители.
Концентрация фосфорной кислоты, синтезированной в этом процессе, обычно составляет от 75 до 85 процентов. Такие уровни концентрации необходимы для производства высококачественной химической продукции. Несколько эффективных установок извлекают чрезвычайно концентрированную фосфорную кислоту (до 99,9%), используя тот же тепловой процесс.
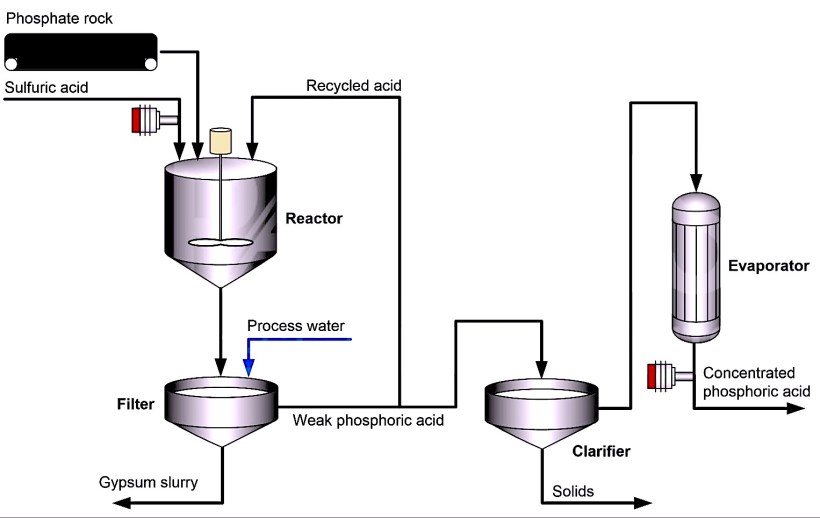
Однако почти 80% фосфорной кислоты производится мокрым способом. В этом методе серная кислота обрабатывается природным фосфатсодержащим минералом, таким как гидроксиапатит.
Минерал высушивают, крошат, а затем подают в реактор вместе с серной кислотой. В результате реакции сульфат сливается с кальцием (из минерала), образуя сульфат кальция (гипс).
Затем добавляется обработанная вода, и гипс вместе с другими нерастворимыми примесями удаляется через фильтр. Фосфорная кислота, полученная этим мокрым способом, содержит 25-30% пятиокиси фосфора.
Обычно эта кислота дополнительно концентрируется, чтобы соответствовать требованиям, предъявляемым к производству удобрений. В большинстве случаев фосфорная кислота концентрируется до 40-55% пятиокиси фосфора с помощью двух / трех вакуумных испарителей.
Свойства
Чистая фосфорная кислота в лаборатории выглядит как плотное, бесцветное, бесформенное кристаллическое твердое вещество, которое плавится при температуре 42,35 °C. Ее физические свойства зависят от чистоты, концентрации кислоты, а также от температуры, при которой вы ее видите.
Фосфорная кислота менее агрессивна и менее опасна по сравнению с азотной и серной кислотами. Это негорючее вещество как в жидкой, так и в твердой форме.
Когда кислота подвергается воздействию тепла, а затем охлаждается до комнатной температуры, она образует прозрачное, хрупкое стекло. После такого воздействия тепла состав кислоты остается прежним.
Обычно фосфорная кислота выпускается в виде бесцветного сиропа с концентрацией в воде 85 процентов и плотностью 1,885 граммов на миллилитр.
В водном растворе фосфорная кислота действует как трипротовая кислота, имеющая три ионизируемых атома водорода. Соединение может потерять эти атомы в виде протонов (ионов H + ).
Кислота растворима как в воде, так и в этаноле. Однако большинство ее солей не растворимы в воде, если нет сильной минеральной кислоты.
Области применения
Фосфорная кислота имеет несколько важных применений. Ее соли, такие как фосфаты аммония и кальция, широко используются в качестве удобрений. Кислота используется для производства электролитов, средств для удаления ржавчины, модификаторов рН, травителей, бытовых чистящих средств и дезинфицирующих средств.
Поскольку это вещество нетоксично и имеет умеренно кислую природу, оно также используется в напитках, пищевых ароматизаторах, косметике, средствах для ухода за зубами и кожей. Давайте подробнее рассмотрим, чем полезна фосфорная кислота.
В менее концентрированной форме она используется для производства различных видов безопасных фосфорных удобрений, которые помогают растениям расти. Фактически, почти 90% синтезированной фосфорной кислоты используется в качестве удобрений.
Многие безалкогольные напитки, в том числе Coca-Cola, содержат фосфорную кислоту. Это придает напитку слегка кисловатый вкус. Несмотря на то, что его концентрация достаточно низкая, экстремальный прием таких напитков может вызвать эрозию зубов и даже привести к образованию почечных камней.
Фосфорная кислота в качестве электролита имеет полезные характеристики, такие как хорошая ионная проводимость, низкая летучесть, стабильность при относительно высоких температурах и устойчивость к диоксиду углерода и монооксиду углерода.
Поскольку чистая фосфорная кислота обладает высокой протонной проводимостью и превосходной термостабильностью, полибензимидазол (PBI), допированный фосфорной кислотой, является наиболее многообещающим среди мембран на основе PBI, которые могут обеспечить хорошую производительность топливных элементов даже при низком уровне увлажнения и температуре 200 °С.
Специфическое применение фосфорной кислоты:
Глобальный рынок
Многие развивающиеся страны начали сосредотачиваться на увеличении добычи фосфатов и производства фосфатов. Правительства некоторых стран уже сотрудничали с различными поставщиками по всему миру для создания заводов по добыче минералов для производства фосфорной кислоты.
В 2019 году объем мирового рынка фосфорной кислоты оценивался в 45,85 миллиарда долларов. Ожидается, что к 2027 году он достигнет более 61 миллиарда долларов, а совокупный годовой темп роста составит 3,7%.
Рынок подразделяется на Азиатско-Тихоокеанский регион, Европу, Северную Америку, Латинскую Америку, Ближний Восток и Африку. Ожидается, что в ближайшем будущем Азиатско-Тихоокеанский регион будет доминировать на мировом рынке. Рост рынка фосфорной кислоты в этих регионах будет дополнительно подпитываться развитым сельскохозяйственным сектором Индии и Китая.
Фосфор
Основное и возбужденное состояние фосфора
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на d-подуровень.
Природные соединения
В промышленности фосфор получают в ходе сплавления фосфата кальция, песка и угля.
Химическая активность фосфора значительно выше, чем у азота. Активность также определяется аллотропной модификацией: наиболее активен белый фосфор, излучающий видимый свет из-за окисления кислородом.
В жидком и газообразном состоянии до 800 °C фосфор состоит из молекул P4. Свыше 800 °C молекулы P4 распадаются до P2.
C неметаллами фосфор часто проявляет себя как восстановитель и окислитель. Легко окисляется кислородом.
Схожим образом происходит взаимодействие фосфора и хлора.
2P + 3Cl2 → 2PCl3 (недостаток хлора)
2P + 5Cl2 → 2PCl5 (избыток хлора)
2P + 3Ca → Ca3P2 (фосфид кальция)
При взаимодействии с водой фосфор вступает в реакцию диспропорционирования (так называются реакции, в которых одно и то же вещество является и окислителем, и восстановителем).
При добавлении фосфора в растворы щелочей также происходит реакция диспропорционирования.
При поджигании спичек происходит реакция между фосфором и бертолетовой солью, которая выступает в качестве окислителя.
Кислотный оксид, пары которого имеют формулу P4O10. Твердый оксид характеризуется белым цветом.
Активно реагирует с водой с образованием фосфорной кислоты. При недостатке воды образует метафосфорную кислоту.
Обладает выраженным водоотнимающим (дегидратационным) свойством: легко извлекает воду из других соединений.
Фосфорные кислоты
Фосфорноватистая кислота способна вытеснять из солей малоактивные металлы, при этом превращаясь в ортофосфорную кислоту.
Ортофосфорная кислота
В твердом виде представляет собой кристаллы белого цвета, хорошо растворимые в воде.
Фосфорную кислоту получают из фосфатов, воздействуя на них серной кислотой. Также известны способы гидролиза пентахлорида фосфора, взаимодействия оксида фосфора V с водой.
Фосфорная кислота может образоваться при окислении фосфора сильной кислотой:
За счет кислотных свойств отлично реагирует с основными оксидами, основаниями. При различных соотношениях кислоты и основания получаются различные соли (фосфаты, гидрофосфаты и дигидрофосфаты).
В реакции с карбонатами образуется нестойкая угольная кислота, которая распадается на воду и углекислый газ.
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из фосфорной кислоты.
При сильном нагревании ортофосфорная кислота теряет воду и переходит в метафосфорную кислоту.
Соли фосфорной кислоты
Соли фосфорной кислоты получаются в ходе реакции ортофосфорной кислоты и оснований.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.