С чем реагирует сульфат натрия
Гидросульфат натрия: способы получения и химические свойства
Гидросульфат натрия NaHSO4 — кислая соль щелочного металла натрия и серной кислоты. Белое кристаллическое вещество. Плавится без разложения, при дальнейшем нагревании разлагается.
Относительная молекулярная масса Mr = 120,06; относительная плотность для ж. и тв. состояния d = 2,742; tпл = 186º C;
Способ получения
1. В результате взаимодействия холодной и концентрированной серной кислоты и гидроксида натрия, образуется гидросульфат натрия и вода:
2. Твердый сульфат натрия реагирует с концентрированной серной кислотой. В результате реакции образуется гидросульфат натрия:
3. При температуре до 50º C в результате реакции между твердым хлоридом натрия и концентрированной серной кислотой происходит образование гидросульфата натрия и газа хлороводорода:
Химические свойства
1. Гидросульфат натрия разлагается при температуре 250–320º C в вакууме с образованием пиросульфата натрия и воды :
2. Гидросульфат натрия может взаимодействовать со сложными веществами :
2.2. С хлоридом натрия гидросульфат натрия реагирует при температуре 450–800º C с образованием сульфата натрия и хлороводородной кислоты:
3. Гидросульфат натрия может взаимодействовать с простыми веществами-металлами :
Сульфат натрия
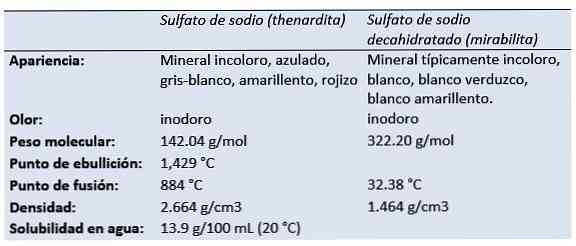
Характеристики и физические свойства сульфата натрия
Кристаллизуется из водных растворов с десятью молекулами воды (Na2SO4×10H2O) и в таком виде называется глауберовой солью по имени немецкого врача и химика И.Р. Глаубера, который первым получил её действием серной кислоты на хлорид натрия.
Рис. 1. Сульфат натрия. Внешний вид.
Таблица 1. Физические свойства сульфата натрия.
Плотность (20 o С), г/см 3
Температура плавления, o С
Растворимость в воде (20 o С), г/100 мл
Получение сульфата натрия
Основной промышленный способ получения сульфата натрия мало чем отличается, от того, что использовал И.Р. Глаубер, когда впервые получил эту соль. Реакция обмена между серной кислотой и хлоридом натрия, проводимая при нагревании до 500 o С в специальной печи:
Кроме этого сульфат натрия встречается в природе в виде минерала тенардита (безводный) и мирабилита (гидрат).
Химические свойства сульфата натрия
В водном растворе сульфат натрия диссоциирует на ионы:
Твердый сульфат натрия взаимодействует с концентрированнойсерной кислотой
Вступает в реакции обмена с кислотными оксидами (1), гидроксидами (2) и солями (3):
Сульфат натрия восстанавливается водородом (4) и углеродом (5):
Применение сульфата натрия
Безводный сульфат натрия применяется для изготовления стекла. Раньше эту соль использовали в качестве одного из составляющих стиральных порошков и другим моющих средств. Кроме этого сульфат натрия нашел применение в текстильной промышленности, кожевенном деле, производстве цветных металлов, а также в химическом анализе.
Примеры решения задач
| Задание | Вычислите объем кислорода, выделяющийся при образовании сульфата натрия по реакции взаимодействии пероксида натрия массой 47,5 г с раствором серной кислоты. |
| Решение | Уравнение реакции имеет следующий вид: |
Рассчитаем количество моль пероксида натрия (молярная масса равна 78 г/моль):
Согласно уравнению реакции n (Na2O2) : n (O2) = 2: 1. Значит,
Тогда, объем выделяющегося кислорода будет равен:
V (O2) = 0,305 × 22,4 = 6,832л.
| Задание | Вычислите количество теплоты, выделяющейся при образовании сульфата натрия из пероксида натрия массой 7,5 г и оксида серы (IV). Термохимическое уравнение реакции имеет следующий вид: |
Согласно уравнению реакции, в неё вступили 1 моль пероксида натрия и 1 моль оксида серы (IV). Рассчитаем массу пероксида натрия по уравнению, т.е. теоретическую массу (молярная масса – 78 г/моль):
Тогда, количество теплоты, выделяющейся в ходе реакции взаимодействия между пероксидом натрия и оксидом серы (IV) равно:
Qprac = 654,4 × 7,5/ 78 = 62,92 кДж.
Сульфат натрия, характеристика, свойства и получение, химические реакции
Сульфат натрия, характеристика, свойства и получение, химические реакции.
Сульфат натрия – неорганическое вещество, имеет химическую формулу Na2SO4.
Краткая характеристика сульфата натрия:
Сульфат натрия – неорганическое вещество белого цвета.
Химическая формула сульфата натрия Na2SO4.
Сульфат натрия – неорганическое химическое соединение, соль серной кислоты и натрия.
Сульфат натрия не токсичен, пожаро- и взрывобезопасен. Пылевоздушная смесь сульфата натрия не взрывоопасна.
В земной коре сульфат натрия находится в свободном чистом состоянии, в форме кристаллогидратов, а также в составе двойных солей.
Сульфат натрия в чистом состоянии широко распространён в природе в виде минерала тенардит.
Сульфат натрия образует с водой кристаллогидраты. Их формула Na2SO4·nH2O, где n может быть 1, 7 или 10. Кристаллогидрат Na2SO4·10H2O известен как минерал мирабилит (глауберова соль). Данный десятиводный кристаллогидрат сульфата натрия впервые обнаружен химиком И. Р. Глаубером в составе минеральных вод.
В пищевой промышленности используется 2 типа сульфата натрия:
– добавка Е514(i) – сульфат натрия (Sodium sulphate) с химической формулой Na2SO4;
– добавка Е514(ii) – гидросульфат натрия (Sodium hydrogen sulphate) с химической формулой NaHSO4.
Физические свойства сульфата натрия:
| Наименование параметра: | Значение: |
| Химическая формула | Na2SO4 |
| Синонимы и названия иностранном языке | sodium sulfate (англ.) |
натрий сернокислый (рус.)
тенардит (рус.)
Получение сульфата натрия:
Промышленный способ получения сульфата натрия заключается в разработке его месторождений в природе.
В лаборатории сульфат натрия получается в результате следующих химических реакция:
Сульфат натрия: способы получения и химические свойства
Сульфат натрия — соль щелочного металла натрия и серной кислоты. Белый. Плавится и кипит без разложения. Хорошо растворяется в воде (гидролиз не идет).
Относительная молекулярная масса Mr = 142,04; относительная плотность для тв. и ж. состояния d = 2,66; tпл = 884º C; tкип = 1430º C.
Способ получения
1. В результате взаимодействия разбавленной серной кислоты и гидроксида натрия образуется сульфат натрия и вода:
2. При температуре 450–800º C гидросульфат натрия реагирует с хлоридом натрия. В результате реакции образуется сульфат натрия и хлороводородная кислота:
NaHSO4 + NaCl = Na2SO4 + HCl
3. В состоянии кипения в результате реакции между твердым хлоридом натрия и концентрированной серной кислотой происходит образование сульфата натрия и газа хлороводорода:
4. Твердый сульфид натрия и кислород взаимодействуют при температуре выше 400º C с образованием сульфата натрия:
5. При взаимодействии концентрированного раствора пероксида водорода и сульфида натрия образуется сульфат натрия и вода:
Качественная реакция
Химические свойства
1. Сульфат натрия может реагировать с простыми веществами :
1.1. Сульфат натрия реагирует со фтором при температуре 100–150º C. При этом образуются фторид натрия, сульфурилфторид и кислород:
1.2. С водородом сульфат натрия реагирует при температуре 550–600º C, в присутствии катализатора Fe2O3 с образованием сульфида натрия и воды:
2. Сульфат натрия вступает в реакцию со многими сложными веществами :
2.1. Сульфат натрия реагирует с гидроксидом бария с образованием гидроксида натрия и сульфата бария:
2.2. При взаимодействии с концентрированной серной кислотой твердый сульфат натрия образует гидросульфат натрия:
Сульфат натрия Формула, свойства, структура, применение
Он считается одним из основных продаваемых химических продуктов. Его мировое производство (почти исключительно в форме декагидрата) составляет около 6 миллионов тонн в год..
Впервые он был описан в 1825 году в Салинас-Эспартинас (Сьемпосуэлос, Мадрид, Испания) и был назван тенардита в честь французского химика Луи Жака Тенара (1777-1826)..
Голландский / немецкий химик и аптекарь Иоганн Рудольф Глаубер (1604-1670) обнаружил в 1625 году в воде австрийского источника декагидрат сульфата натрия (позже известный как соль Глаубера). Он назвал это солью mirabilis (чудодейственная соль), из-за ее целебных свойств.
Между 1650 и 1660 годами Глаубер начал производить сульфат натрия из поваренной соли (NaCl) и концентрированной серной кислоты. Этот процесс считается началом химической промышленности.
Его кристаллы использовались в качестве слабительного до 20-го века.
В восемнадцатом веке реакция глауберова соли с калием (карбонат калия) начала использоваться в промышленном производстве кальцинированной соды (карбонат натрия)..
В настоящее время он используется в основном для производства моющих средств и в процессе крафт-производства бумажной массы (доминирующий метод в производстве бумаги).
Месторождения сульфата натрия находятся в Соединенных Штатах, Канаде, Испании, Италии, Турции, Румынии, Мексике, Ботсване, Китае, Египте, Монголии и Южной Африке..
Основными производителями являются Китай (провинции Цзянсу и Сычуань), за которым следует Испания, где находится крупнейшее в мире месторождение глауберита (в Сересо-де-Рио-Тирон, Бургос)..
Общее мировое производство природного сульфата натрия оценивается примерно в 8 миллионов тонн, а это как побочный продукт других промышленных процессов от 2 до 4 млн. Тонн..
В Испании, согласно информации, опубликованной в Национальной инвентаризации ресурсов сульфата натрия, и другим обновленным данным, оценочные запасы минералов сульфата натрия порядка 730 млн. Тонн занесены в каталог как «запасы», а еще 300 млн. Тонн внесены в каталог «прочие ресурсы»..
В Европейском Союзе Испания в настоящее время является единственной страной с рудами сульфата натрия (главным образом, терардита, глауберита и мирабилита)..
В настоящее время наблюдается общее снижение спроса на сульфат натрия в текстильной промышленности..
В последние годы в некоторых регионах, таких как моющие средства, наблюдается некоторый рост в связи с их низкой ценой в качестве сырья..
Основные расширяющиеся рынки моющих средств на основе сульфата натрия находятся в Азии, Центральной Америке и Южной Америке..
формулы
2D структура
3D структура
черты
Физико-химические свойства
Сульфат натрия относится к реакционноспособной группе соединений натрия, а также к группе сульфатов, гидросульфатов и дисульфитов..
воспламеняемость
Это негорючее вещество. Нет риска взрыва его порошков.
реактивность
Сульфат натрия очень хорошо растворяется в воде и гигроскопичен. Он очень стабилен, не реагирует на большинство окислителей или восстановителей при нормальных температурах. При высоких температурах его можно превратить в сульфид натрия путем карботермического восстановления..
Химически нереакционноспособные вещества считаются нереакционноспособными в типичных условиях окружающей среды (хотя они могут вступать в реакцию при относительно экстремальных условиях или при катализе). Они устойчивы к окислению и восстановлению (кроме экстремальных условий).
Опасные химические реакции
токсичность
Химически нереактивные вещества считаются нетоксичными (хотя газообразные вещества из этой группы могут действовать как удушающие вещества).
Хотя сульфат натрия обычно считается нетоксичным, с ним следует обращаться осторожно. Порошок может вызвать астму или временное раздражение глаз. Этого риска можно избежать, надев защитные очки и бумажную маску.
приложений
Основные области его применения: производство
Другое использование сульфата натрия, значение которого уменьшается, особенно в США. и Канада, в процессе крафт-производства для производства древесной массы. Достижения в области термической эффективности процесса резко сократили потребность в сульфате натрия.
Стекольная промышленность обеспечивает еще одно важное применение для сульфата натрия. Это второе по величине приложение в Европе. Сульфат натрия используется для устранения небольших пузырьков воздуха из расплавленного стекла.
В Японии самое большое применение сульфата натрия в производстве текстиля. Сульфат натрия помогает красителям равномерно проникать в волокна и не разъедает сосуды из нержавеющей стали, используемые при крашении (в отличие от хлорида натрия, который является альтернативным методом).
Сульфат натрия особенно подходит для хранения солнечного тепла низкого качества (для последующего выделения при нагревании) из-за его высокой теплоемкости при переходе фазы от твердого к жидкому, которое дается при 32 ° C.
При охлаждении смесь с поваренной солью хлорида натрия (NaCl) снижает температуру плавления до 18 ° C..
В лаборатории безводный сульфат натрия широко используется в качестве инертного осушителя для удаления следов воды из органических растворов. Его действие медленнее, чем у сульфата магния, но его можно использовать с различными материалами, поскольку он химически довольно инертен.
В качестве слабительного средства исторически использовался декагидрат сульфата натрия (глауберова соль). Он эффективен для устранения определенных препаратов, таких как ацетаминофен (acetaminophen), из организма после передозировки..
Другие области применения сульфата натрия включают его использование в качестве добавки при изготовлении освежителей воздуха для ковров, в качестве добавки в корм для скота и в производстве крахмала..
Клинические эффекты
По своему терапевтическому применению сульфат натрия относится к категории солевых и слабительных слабительных средств, используемых при лечении запоров..
Катализаторы в солевом растворе плохо всасываются желудочно-кишечным трактом, поэтому системная токсичность маловероятна, если не поступить в организм в больших количествах. Тем не менее, большое воздействие может вызвать дегидратацию и электролитные изменения, вторичные к осмотическим эффектам соединения..
Хроническое злоупотребление слабительным может иметь место у пациентов с расстройствами пищевого поведения, синдромом Мюнхгаузена или искусственными расстройствами. В целом, пациенты испытывают тошноту, рвоту и диарею, связанные со спазмами в животе. Тяжелые последствия могут включать обезвоживание, гипотензию, гипернатриемию и нарушения электролитного баланса..
Безопасность и риски
Заявления об опасности Глобально согласованной системы классификации и маркировки химических веществ (SGA).
Согласованная на глобальном уровне система классификации и маркировки химических веществ (SGA) представляет собой согласованную на международном уровне систему, созданную Организацией Объединенных Наций и призванную заменить различные стандарты классификации и маркировки, используемые в разных странах, путем использования согласованных глобальных критериев (Организация Объединенных Наций). United, 2015).
Классы опасности (и соответствующая им глава СГС), стандарты классификации и маркировки и рекомендации по сульфату натрия являются следующими (Европейское химическое агентство, 2017, Организация Объединенных Наций, 2015, PubChem, 2017):
Классы опасности СГС
Коды пруденциальных советов
P261, P264, P272, P273, P280, P302 + P352, P305 + P351 + P338, P321, P332 + P313, P333 + P313, P337 + P313, P362, P363 и P501.