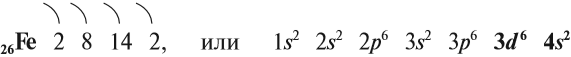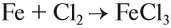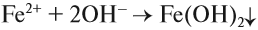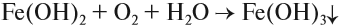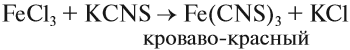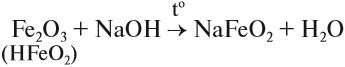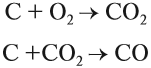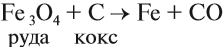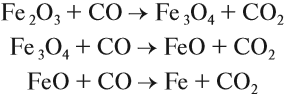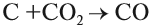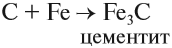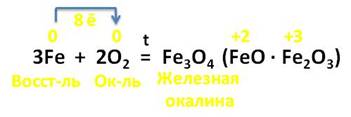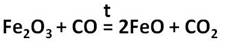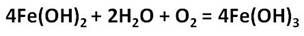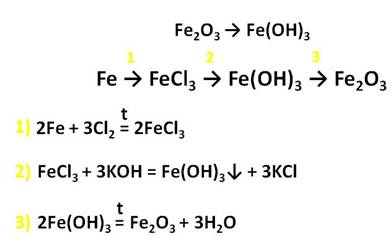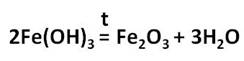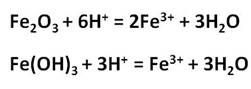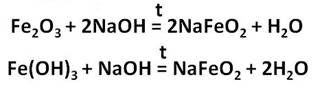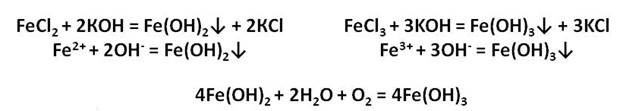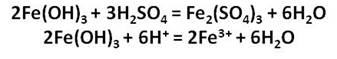С чем реагирует железо при обычных условиях
Физические и химические свойства железа
А томный номер — 26. Символ – Fe (лат. «ferrum»). Один из самых распространённых в земной коре металлов (второе место после алюминия).
Физические свойства железа
Механические свойства железа зависят от его чистоты – содержания в нем даже весьма малых количеств других элементов. Твердое железо обладает способностью растворять в себе многие элементы.
Химические свойства железа
Во влажном воздухе железо быстро ржавеет, т.е. покрывается бурым налетом гидратированного оксида железа, который вследствие своей рыхлости не защищает железо от дальнейшего окисления. В воде железо интенсивно корродирует; при обильном доступе кислорода образуются гидратные формы оксида железа (III):
При недостатке кислорода или при затрудненном доступе образуется смешанный оксид (II, III) Fe3O4:
Железо растворяется в соляной кислоте любой концентрации:
Аналогично происходит растворение в разбавленной серной кислоте:
В концентрированных растворах серной кислоты железо окисляется до железа (III):
Однако, в серной кислоте, концентрация которой близка к 100%, железо становится пассивным и взаимодействия практически не происходит. В разбавленных и умеренно концентрированных растворах азотной кислоты железо растворяется:
При высоких концентрациях азотной кислоты растворение замедляется и железо становится пассивным.
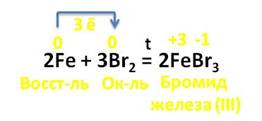
Как и другие металлы железо вступает в реакции с простыми веществами. Реакции взаимодействия железа с галогенами (вне зависимости от типа галогена) протекают при нагревании. Взаимодействие железа с бромом протекает при повышенном давлении паров последнего:
Взаимодействие железа с серой (порошок), азотом и фосфором также происходит при нагревании:
Железо способно реагировать с такими неметаллами, как углерод и кремний:
Среди реакций взаимодействия железа со сложными веществами особую роль играют следующие реакции — железо способно восстанавливать металлы, стоящие в ряду активности правее него, из растворов солей (1), восстанавливать соединения железа (III) (2):
Железо, при повышенном давлении, реагирует с несолеобразующим оксидом – СО с образованием веществ сложного состава – карбонилов — Fe(CO)5, Fe2(CO)9 и Fe3(CO)12.
Железо при отсутствии примесей устойчиво в воде и в разбавленных растворах щелочей.
Получение железа
Основной способ получения железа – из железной руды (гематит, магнетит) или электролиз растворов его солей (в этом случае получают «чистое» железо, т.е. железо без примесей).
Примеры решения задач
| Задание | Железная окалина Fe3O4 массой 10 г была сначала обработана 150 мл раствора соляной кислоты (плотность 1,1 г/мл) с массовой долей хлороводорода 20%, а затем в полученный раствор добавили избыток железа. Определите состав раствора (в % по массе). |
| Решение | Запишем уравнения реакций согласно условию задачи: |
Зная плотность и объем раствора соляной кислоты, можно найти его массу:
msol(HCl) = 150×1,1 = 165 г.
Рассчитаем массу хлороводорода:
m(HCl) = 165×20%/100% = 33 г.
Молярная масса (масса одного моль) соляной кислоты, рассчитанная с помощью таблицы химических элементов Д.И. Менделеева – 36,5 г/моль. Найдем количество вещества хлороводорода:
v(HCl) = 33/36,5 = 0,904 моль.
Молярная масса (масса одного моль) окалины, рассчитанная с помощью таблицы химических элементов Д.И. Менделеева – 232 г/моль. Найдем количество вещества окалины:
Согласно уравнению 1, v(HCl): v(Fe3O4) = 1:8, следовательно, v(HCl) = 8 v(Fe3O4) = 0,344 моль. Тогда, количество вещества хлородорода, рассчитанное по уравнению (0,344 моль) будет меньше, чем указанное в условии задачи (0,904 моль). Следовательно, соляная кислота находится в избытке и будет протекать еще одна реакция:
Определим количество вещества хлоридов железа, образующихся в результате первой реакции (индексами обозначим конкретную реакцию):
Определим количество хлороводорода, которое не прореагировало в реакции 1 и количество вещества хлорида железа (II), образовавшееся в ходе реакции 3:
vrem(HCl) = v(HCl) – v1(HCl) = 0,904 – 0,344 = 0,56 моль;
Определим количество вещества FeCl2, образовавшегося в ходе реакции 2, общее количество вещества FeCl2 и его массу:
Определим количество вещества и массу железа, вступившего в реакции 2 и 3:
m(Fe) = vsum(Fe) ×M(Fe) = 0,323 ×56 = 18,088 г.
Вычислим количество вещества и массу водорода, выделившегося в реакции 3:
Определяем массу полученного раствора m’sol и массовую долю FeCl2 в нём:
m’sol = 165 + 10 + 18,088 – 0,56 = 192,528 г;
| Задание | Какие процессу будут протекать при погружении цинковой пластинки в раствор хлорида железа (II)? Как изменится масса хлорида железа (II) в растворе? |
| Решение | Хлорид железа (II) в растворе подвергается гидролизу: |
FeCl2 + HOH ↔FeOHCl +HCl;
Цинк будет взаимодействовать с кислотой:
Zn 
Так как цинк более активный металл, чем железо (расположен в ряду напряжений левее железа), то он вытесняет железо из соли:
Zn 

В результате, масса хлорида железа (II) в растворе уменьшится.
Урок 11. Железо
Свойства железа и его соединений
Железо — химический элемент восьмой группы, четвёртого периода, следовательно, строение его атома можно изобразить схемой:
Железо — очень распространённый элемент периодической системы. Среди химических элементов, которые входят в состав Земной коры, оно занимает четвёртое место. В центре Земли имеется массивное железно-никелевое ядро, которое обеспечивает естественный магнетизм Земли.
Хотя атом железа в соединениях может проявлять степени окисления +2, +3, +6, в природе встречаются соединения преимущественно трёхвалентного железа:
Все эти руды имеют буро-красную окраску. Интересно, что от этой окраски произошло слово руда: «рудый» означает «рыжий». Дело в том, что железные руды встретились человеку давным-давно, и с освоения этих руд началась наша цивилизация, поскольку для разработки технологии выплавки железа из руды потребовались значительные интеллектуальные усилия, все знания, которых накопил человек.
Атомы железа (II) входят в состав гемоглобина крови. Именно эти атомы связывают кислород и транспортируют его по всем клеткам нашего организма. При этом атом железа становится трёхвалентным, с характерной для этого состояния «кровавой» окраской. Кстати, название руды «гематит» и означает «кровавый».
Железо — серебристо-белый пластичный металл. Это металл средней активности, тем не менее оно может реагировать с активными неметаллами (галогены, кислород, сера, углерод), кислотами, а при особых условиях — с водой. При этом если реакция происходит с сильным окислителем, то образуется соединение трёхвалентного железа. Впрочем, если в результате реакции образуется соединение двухвалентного железа, то на воздухе это соединение быстро окисляется до трёхвалентного состояния. Например, с сильным окислителем хлором образуется хлорид Fe (III):
А при взаимодействии с соляной кислотой, атом хлора которой может проявлять только восстановительные свойства, образуется хлорид железа (II).
Задание 11.1. Составить уравнение реакции взаимодействия железа с серой, водой, соляной кислотой, разбавленной азотной кислотой.
Соли железа (II) и (III) имеют разную окраску: растворы соединений железа (II) бесцветные, а растворы железа (III) — окрашены в жёлтый цвет.
При взаимодействии с щелочами из растворов солей железа можно получить его гидроксиды. Они так сильно отличаются друг от друга по цвету, что эту реакцию можно считать качественной на соединения железа с разной степенью окисления. Так, из солей Fe (II) выделяется белый (в инертной атмосфере) осадок, который на воздухе мгновенно зеленеет:
На воздухе этот осадок «ржавеет», становится буро-оранжевым. Состав полученного осадка очень близок к составу ржавчины:
Наиболее чувствительной качественной реакцией на Fe 3+ является реакция с роданидом калия:
Оксид и гидроксид железа (II) проявляют основные свойства, т. е. реагируют с кислотами, но не реагируют со щелочами. В отличие от них, оксид и гидроксид железа (III) проявляют слабые амфотерные свойства. Это означает, что при обычных условиях эти вещества реагируют с кислотами и не реагируют со щелочами, но при сплавлении они со щелочами реагируют:
Кроме того, они растворяются в горячих, концентрированных растворах щелочей.
Таким образом, на примере свойств соединений железа ещё раз убеждаемся в справедливости закономерности: при возрастании степени окисления атома металла усиливаются и кислотные, и окислительные свойства соединений.
Действительно, для соединений двухвалентного железа характерны восстановительные свойства: они окисляются просто на воздухе. Для соединений трёхвалентного железа характерны окислительные свойства, они могут находиться в растворе длительное время. Единственное, что «угрожает» солям трёхвалентного железа, — гидролиз, поскольку эти соли соответствуют более слабому основанию.
Задание 11.2. Составьте уравнение реакции гидролиза хлорида железа (III).
Получение железа (чугуна и стали)
Производство чугуна основано на восстановительных свойствах углерода. Чугун образуется в домнах, куда загружают смесь кокса и железной руды. В результате горения кокса образуется необходимое для реакции тепло и сильный восстановитель — угарный газ:
Впрочем, и кокс является прекрасным восстановителем:
Угарный газ является основным восстановителем доменного процесса, поскольку ввиду газообразного состояния имеет высокую реакционную способность, способен проникать в любую точку домны. Кроме того, он не образует цементита. Эти реакции восстановления происходят при температуре 450…700 °C:
Полученный углекислый газ, реагируя с избытком кокса, вновь превращается в угарный газ:
и процесс продолжается. Он происходит в верхней части домны. Выделяющееся в твёрдом виде железо опускается в нижнюю часть домны, контактирует с коксом, начинает плавиться, так как температура в этой части печи превышает 1300 °C. Кокс, образуя сплав с железом (чугун), понижает температуру плавления железа на 400°; одновременно с этим часть железа образует цементит:
Для предохранения расплавленного железа от окисления в исходную смесь добавляют флюсы. Это известняк, который является поставщиком углекислого газа и, всплывая на поверхность, образует защитную плёнку.
Полученный чугун содержит до 4,5 % углерода, он используется для получения стали. Цель переработки — удаление примесей углерода, фосфора, серы. Готовая сталь должна содержать 0,3…2 % углерода. Кроме того, в сталь вводят различные добавки, которые изменяют её свойства. Так, нержавеющая сталь содержит около 12 % хрома.
Сталь является основным сплавом машиностроения, но легко ржавеет, так как подвергается коррозии (см. урок 8.4).
Выводы
Железо — главный металл нашей цивилизации. Станки, различные машины и механизмы, строительные конструкции, мосты, трубы — всё состоит из железа, точнее, стали или чугуна. Это достаточно активный металл, поэтому легко образует различные соединения, в которых чаще всего проявляет валентность III. Такие соединения имеют обычно красно-коричневую окраску (ржавчина).
Железо, его соединения
Урок 14. Химия 9 класс ФГОС
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Железо, его соединения»
Железо, его соединения
Сначала рассмотрим особенностей строение атома железа.
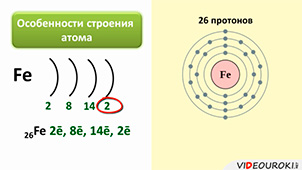
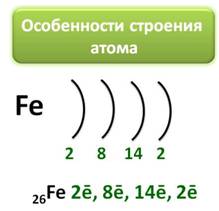
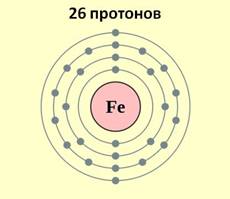
Железо является элементом побочной подгруппы VIII A группы. Поэтому его электронное строение отличается от строения электронных оболочек элементов главных подгрупп. Так как железо расположено в 4 периоде, то атомы его имеют четыре энэргетических уровня, к тому же заполняется у него сначала не внешний, а предвнешний энэргетический уровень. В ядре атома железа содержится 26 протонов. На внешнем энэргетическом уровне у атома железа находится два электрона, а на предвнешнем – 14.
Железо имеет на внешнем энэргетическом уровне два электрона, является металлом, поэтому как и все металлы он отдаёт электроны и проявляет восстановительные свойства. Если атом железа отдаёт два внешних электрона, тогда он приобретает степень окисления +2, к тому же электрон с предвнешнего уровня тоже может оторваться, тогда степень окисления становится +3.
Рассмотрим железо, как простое вещество.
· блестящий серебристо-белый металл
· имеет темературу плавления 1539 0 С
· плотность железа 7,87 г/см 3
· железо пластичное и ковкое, поэтому легко обрабатывается
· обладает способностью намагничиваться и размагничиваться.
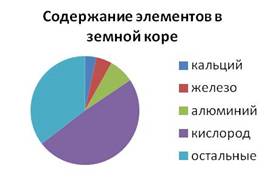
По распространённости в земной коре железо занимает четвёртое место и второе среди металлов (после алюминия). Его массовая доля в земной коре составляет четыре целых шестьдесят пять сотых процента.
Железо образует ряд минералов:
· большое значение имеет и железный колчедан, или пирит FeS2 который используют при произвостве серной кислоты
· в природных и некоторых минеральных водах встречается гидрокарбонат железа – Fe(HCO3)2
Вообще, различают технически чистое и химически чистое железо. Технически чистое железо представляет собой низкоуглеродистую сталь, содержащую 0,02 – 0,04 % углерода, а также небольшое содержание кислорода, серы, азота и фосфора. Химически чисто железо содержит 0,01 % примесей.
Из технически чистого железа сделаны канцелярские скрепки, кнопки, но оно легко корродирует.
Химически чистое железо, напротив, почти не корродирует. Вот почему железная колонна в Дэли, построенная ещё в пятнадцатом веке не ржавеет, потому что она сделана из чистого железа.
С железом человек знаком очень давно. Считается, что первое железо было метеоритного происхождения. В переводе с древнего шумерского языка «железо» ― это «капнувший с неба, небесный». В настоящее время зафиксировано около пятисот железных метеоритов. Самый крупный железный метеорит массой шестьдесят тонн найден более семидесяти лет назад в Юго-Западной Африке, второй по величине – массой тридцать тонн – столетием раньше в Гренландии.

Алхимики обозначали железо в виде копья и щита, которые символизировали бога войны Марса.

Для современного человека железо играет огромную роль, ведь имеено оно составляет основу техники и машиностроения. Железо как никакой другой металл способен изменять свои технические характеристики в результате легирования и специальной обработки. В настоящее время известно очень много сплавов этого металла, отличающихся разнообразием свойств:
· устойчивые в морской воде
· выдерживающие действие высоких температур и агрессивных сред
· мягкие для производства проволоки
· жёсткие для производства пружин
· магнитные и немагнитные.
Широко используются чугун и сталь. Оксид железа (III) используется как пигмент в производстве красок (охра).
Железо можно получить восстановлением из железных руд углеродом (коксом), оксидом углерода два, водородом, алюминием, то есть пирометаллургическим способом.
Изучая химические свойства железа, следует учитывать, что оно может иметь степень окисления +2 и +3. Это всё зависит от окислительной способности тех веществ, с которыми реагирует железо.
Железо реагирует с простыми и сложными веществами. Однако оно малоактивно при обычных условиях.
А вот в реакции железа с кислородом, образуется железная окалина, состоящая из оксидов железа (II) и (III). В этой реакции 3 атома железа отдаёт 8 электронов молекуле кислорода, выступая в роли восстановителя, а кислород – в роли окислителя.
Железо реагирует и со сложными веществами.
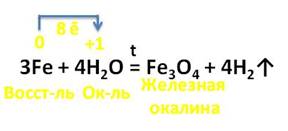
Например, с парами воды железо реагирует при нагревании, при этом образуется опять железная окалина и выделяется водород. Здесь также три атома железа отдают 8 электронов ионам водорода, железо является восстановителем, а ионы водорода – окислителем.
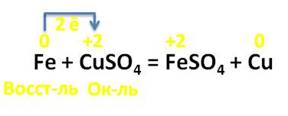
Железо взаимодействует с растворами солей, оно вытесняет металлы, которые стоят правее его в электрохимическом ряду напряжений металлов. Например, в реакции с раствором сульфата меди (II), железо вытесняет медь. В этой реакции железо повышает свою степень окисления с 0 до +2, а медь, наоборот, понижает свою степень окисления с +2 до 0. Каждый атом железа отдаёт по 2 электрона ионам меди. Железо выступает в роли восстановителя, а медь – в роли окислителя.
С растворами кислот железо также реагирует. Например, в реакции с разбавленной соляной кислотой железо окисляется до соли железа со степенью окисления железа +2. Эту реакцию можно наблюдать наглядно: для этого следует налить в пробирку раствора соляной кислоты и поместить туда кусочек железа, при этом можно наблюдать выделение пузырьков газа. Это выделяется водород. Причём ещё образуется и соль – хлорид железа (II).
В уравнении реакции каждый атом железа отдаёт по два электрона ионам водорода. Железо изменяет свою степень окисления с 0 до +2, при этом является восстановителем, а водород понижает свою степень окисления с +1 до 0 и ионы водорода являются окислителем.
А концентрированная серная и азотная кислоты не реагируют с железом, потому что они пассивируют его, образуя на поверхности металла прочную оксидную плёнку.
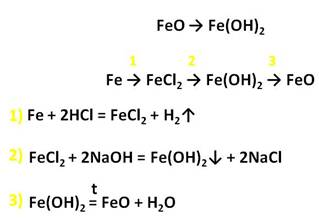
У железа со степенью окисления +2 есть ряд соединений. Например, FeO – оксид железа (II) и гидроксид желза два. Прямой реакцией получить гидроксид железа два из оксида железа два невозможно, нужно сначала получить соль железа, а только потом гидроксид.
Осуществим следующие превращения: получим хлорид железа (II) из железа, затем из хлорида железа (II) получим гидроксид железа (II), а потом и оксид железа (II).
Для того, чтобы получить хлорид железа (II) в первой стадии, необходимо, чтобы железо прореагировало с разбавленной соляной кислотой, затем к хлориду железа (II) следует добавить щёлочь, например, гидроксид натрия. Таким образом, мы получим гидроксид железа (II), а прокаливая нерастворимое в воде основание гидроксид железа (II) мы сможем получить и оксид железа (II).
Оксид и гидроксид железа (II) обладает ярко выраженными основными свойствами и реагируют с кислотами. В резульате данных реакций образуются соли железа, в которых степень окисления железа +2.
Оксид железа (II) представляет собой порошок чёрного цвета. Его получают восстановлением оксида железа (III) оксидом углерода (II).
Ионы железа легко окисляются кислородом воздуха или другими окислителями до иона железа +3. Из-за этого окисления зелёный осадок гидроксида железа (II) превращается в гидроксид железа (III) бурого цвета.
Оксид железа (III) – Fe2O3 – порошок бурого цвета, его получают разложением гидроксида железа (III).
Оксид и гидроксид железа (III) проявляют слабовыраженные амфотэрные свойства и легко реагируют с кислотами, в результате чего образуются соли железа, в которых его степень окисления +3.
Реакции с концентрированными растворами щелочей протекают лишь при длительном нагревании с образованием ферритов: в результате взаимодействия оксида железа (III) с гидроксидом натрия, образуется феррит натрия, в результате взаимодействия гидроксида железа (III) с гидроксидом натрия, образуется также феррит натрия.
Получим гидроксиды железа (II) и (III) и исследуем их свойства. Для этого, нальём в две пробирки соль железа – хлорида железа (II) и хлорида железа (III). А затем добавим в каждую из них раствора щёлочи, после чего мы можем наблюдать выпадение осадков: в первой пробирке осадок белого цвета, который становится сразу зелёного цвета, а во второй – осадок бурого цвета. Однако со временем, осадок в первой пробирке начинает приобретать бурую окраску за счёт окислительных процессов. Если добавить к этим двум осадкам раствора серной кислоты, то осадок растворяется и в первой и во второй пробирке.
Соли железа имеют большое значение. Так кристаллогидрат сульфата железа (II) FeSO4 ∙ 7H2O, или железный купорос используется для борьбы с вредителями растений и при приготовлении минеральных красок, а также для обработки древесины.
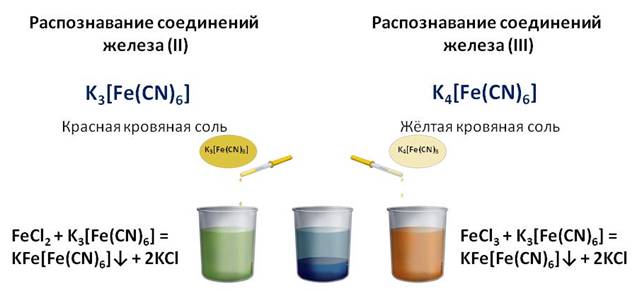
Для распознавания соединений железа (II) и (III) проводят качественные реакции на эти ионы. Так, качественной реакцией на ион железа (II) служит реакция с красной кровяной солью, а реактивом на ион железа (III) является жёлтая кровяная соль. Если к соединениям железа (II) и (III) добавить соответственно красной и жёлтой кровяной соли, то в обоих случаях образуется синий осадок.
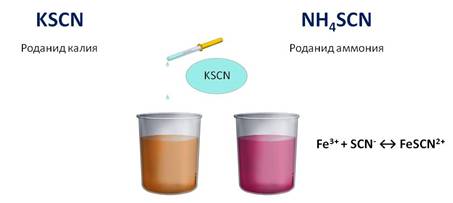
Для обнаружения ионов железа (III) можно использовать и роданид калия или аммония. При этом образуется раствор кроваво-красного цвета.
Роль железа в жизнедеятельности очень велика. Массовая доля железа в животных организмах составляет около одной сотой процента. В организме человека содержится около пяти г железа, главным образом в составе гемоглобина, фермента каталазы. Соединения железа применяют при лечении малокровия, истощении, упадке сил. Суточная потребность человека в железе составляет около пятнадцать тысячных грамма. Железо содержится в шпинате, салате, капусте, чёрной смородине, мясе, сливовом соке, кураге, изюме, семечках тыквы и подсолнуха, чёрном хлебе и других продуктах.