С чем реагируют оксиды неметаллов
Уроки по неорганической химии для подготовки к ЕГЭ
Свойства простых веществ:
Свойства сложных веществ:
Особенности протекания реакций:
Химические свойства неметаллов
1. Галогены
1) С кислородом из галогенов реагирует только фтор:
2) С водой реагируют все галогены, но по-разному: фтор окисляет воду, другие галогены диспропорционируют в ней:
3) Все галогены взаимодействуют с водородом:
4) Из солей галогены реагируют: 1) с галогенидами (если галоген в простом веществе является более сильным окислителем, чем галоген в соли) и 2) с сульфидами:
Cl2 + CaF2 → реакция не идет, так как Cl2 обладает менее выраженными окислительными свойствами, чем F2.
Если можем окислить металл:
5) Все галогены реагируют с металлами:
Окислительный свойства йода выражены слабее, чем у других галогенов, поэтому с такими металлами, как Fe и Cu, он взаимодействует по-другому:
7) Не реагируют с оксидами
8) Не реагируют с кислотами за исключением одной реакции (только I2 и только с концентрированной азотной кислотой):
9) Диспропорционируют в растворах щелочей:
2F2 + 2NaOH → OF2 + 2NaF + H2O (продукты этой реакции на ЕГЭ не проверяются, но необходимо знать, что реакция протекает)
Cl2 + 2NaOH → NaCl + NaClO + H2O (аналогично для Br2, I2)
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O (при нагревании, аналогично для Br2, I2).
2. Сера (желтое вещество, плавает на поверхности воды, не смачиваясь ею)
1) реагирует с кислородом:
2) Реагирует с водородом:
3) Реагирует с металлами
4) Реагирует со всеми неметаллами, :
S + N2 → реакция не идет
S + I2 → реакция не идет
5) Реагирует с кислотами-окислителями:
3. Азот (прочная тройная связь)
Реагирует только с O2, H2, F2 (со фтором реакции на ЕГЭ не встречаются) и металлами.
1) Реагирует с кислородом (электрический разряд или 2000ºС)
2) Реагирует с водородом (обратимая, экзотермическая реакция):
4) Не реагирует с H2O, кислотами, оксидами, солями.
4. Фосфор
1) Реагирует с кислородом:
2) Не реагирует с водородом:
P + H2 → реакция не идет.
3) Диспропорционирует в растворах щелочей:
4) Реагирует с кислотами-окислителями:
5) Окисляется сильными окислителями:
6) Реагирует с металлами с образованием фосфидов:
7) Реагирует с серой, галогенами:
2P + 3I2 → 2PI3 (с I2 возможно только образованием PI3, PI5 не образуется)
8) Реагирует с соединениями P +5 :
3PCl5 + 2P → 5PCl3
5. Углерод
1) Реагирует с кислородом:
2) Реагирует с водородом:
3) Реагирует с кислотами-окислителями:
4) Используется при получении фосфора:
6. Кремний
1) Реагирует с кислородом:
2) Не реагирует с водородом:
Si + H2 → реакция не идет.
3) Растворяется в щелочах:
4) Не реагирует с растворами кислот. Реагирует только с HF:
Химия, Биология, подготовка к ГИА и ЕГЭ
Вопрос А10 ГИА (ОГЭ) по химии —
Химические свойства оксидов: основных, амфотерных, кислотных
Классификация оксидов:
Оксиды, образованные металлами
Оксиды, образованные неметаллами
Основные
Кислотные
Несолеобразующие
— Na2O, CaO;
оксиды d-элементов в низших с.о. — CrO, FeO
d-элементы в средней с.о. — Cr2O3, Fe2O3, MnO2
1) оксиды неметаллов в высших и средних степенях окисления
CO2, N2O3, N2O5, SO3, SO2
2) оксиды d-элементов в высшей с.о.:
оксиды неметаллов в промежуточных степенях окисления:
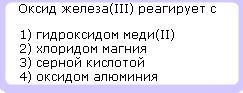
Химические свойства основных оксидов:
Основные оксиды — это сложные химические вещества, относящиеся к окислам, которые образуют соли при химической реакции с кислотами или кислотными оксидами и не реагируют с основаниями или основными оксидами.
Оксиды щелочных и щелочноземельных металлов реагируют с водой с образованием щелочей:
1. Окисление кислородом:
если металл — d-элемент и «ему есть до чего окисляться»: 2FeO + O2 = Fe2O3
2. Взаимодействие с неметаллами:
2Na2O + S = 4Na + SO2
Fe2O3 + C = 2FeO + CO
3. Восстановление — реакции с водородом:
4. Образование солей с кислотными оксидами:
CaO + CO2 = CaCO3 (соль)
5. Взаимодействие с кислотами:
BaO + 2HNO3 = Ba(NO3)2 (соль) + H2O
Химические свойства амофтерных оксидов:
Амфотерные оксиды — это сложные химические вещества, также относящиеся к окислам, которые образуют соли
при химическом взаимодействии и с кислотами (или кислотными оксидами) и основаниями (или основными оксидами).
1. Взаимодействие в растворе(!) с щелочами:
Al2O3 + 2H2O + 2NaOH = 2Na[Al(OH)4] + 3H2
2. Образование солей с кислотами:
ZnO + H2SO4 = ZnSO4 + H2O
Химические свойства кислотных оксидов:
Кислотные оксиды — это сложные химические вещества, относящиеся к окислам, которые образуют соли при химическом взаимодействии с основаниями или основными оксидами и не взаимодействуют с кислотными оксидами.
Реакция с водой: образование кислот:
1. + O2
если элемент, образующий оксид в средней с.о.:
2. + H2
восстановление до несолеобразующего оксида или простого вещества:
3. + вещества. образованные металлами:
SO2 + CaO = CaSO3 (соль)
SO2 + 2LiOH = Li2SO3 + H2O
Химические свойства несолеобразующих оксидов
здесь все просто — они только
окисляются до кислотных и восстанавливаются до простых веществ:
Химические свойства неметаллов
1. Водород проявляет свойства окислителя и свойства восстановителя. Поэтому водород реагирует с металлами и неметаллами.
1.1. С активными металлами водород реагирует с образованием гидридов:
2Na + H2 → 2NaH
1.2. В специальных условиях водород реагирует с серой с образованием бинарного соединения сероводорода:
1.3. Водород не реагирует с кремнием.
1.4. С азотом водород реагирует при нагревании под давлением в присутствии катализатора с образованием аммиака:
1.5. В специальных условиях водород реагирует с углеродом.
1.6. Водород горит, взаимодействует с кислородом со взрывом:
2. Водород взаимодействует со сложными веществами:
2.1. Восстанавливает металлы из основных и амфотерных оксидов. Восстановить из оксида водородом можно металлы, расположенные в электрохимическом ряду напряжений после алюминия. При этом образуются металл и вода.
Например, водород взаимодействует с оксидом цинка с образованием цинка и воды:
ZnO + H2 → Zn + H2O
Также водород восстанавливает медь из оксида меди:
СuO + H2 → Cu + H2O
Водород восстанавливает оксиды некоторых неметаллов.
2.2. С органическими веществами водород вступает в реакции присоединения (реакции гидрирования).
Химические свойства галогенов
Химическая активность галогенов увеличивается снизу вверх – от астата к фтору.
1.1. Галогены не горят на воздухе. Фтор окисляет кислород с образованием фторида кислорода:
1.2. При взаимодействии галогенов с серой образуются галогениды серы:
1.3. При взаимодействии фосфора и углерода с галогенами образуются галогениды фосфора и углерода:
1.4. При взаимодействии с металлами галогены проявляют свойства окислителей, образуя галогениды.
3Cl2 + 2Fe → 2FeCl3
Аналогичная ситуация с медью : фтор, хлор и бром окисляют медь до галогенидов меди (II),а йод до йодида меди (I):
I2 + 2Cu → 2CuI
Активные металлы бурно реагируют с галогенами, особенно с фтором и хлором (горят в атмосфере фтора или хлора).
Еще пример : алюминий взаимодействует с хлором с образованием хлорида алюминия:
3Cl2 + 2Al → 2AlCl3
1.5. Водород горит в атмосфере фтора:
С хлором водород реагирует только при нагревании или освещении. При этом реакция протекает со взрывом:
Бром также реагирует с водородом с образованием бромоводорода:
Взаимодействие йода с водородом происходит только при сильном нагревании, реакция протекает обратимо, с поглощением теплоты (эндотермическая):
1.6. Галогены реагируют с галогенами. Более активные галогены окисляют менее активные.
2. Со сложными веществами галогены реагируют, также проявляя преимущественно окислительные свойства. Галогены охотно диспропорционируют при растворении в воде или в щелочах.
2.1. При растворении в воде хлор и бром частично диспропорционируют, повышая и понижая степень окисления. Фтор окисляет воду.
Cl2 + H2O ↔ HCl + HClO
Фтор реагирует с водой со взрывом:
2.2. При растворении в щелочах хлор, бром и йод диспропорционируют с образованием различных солей. Фтор окисляет щелочи.
При взаимодействии с горячим раствором гидроксида натрия образуются хлорид и хлорат:
Еще пример : хлор растворяется в холодном растворе гидроксида кальция:
2.3. Более активные галогены вытесняют менее активные галогены из солей и галогеноводородов.
Cl2 + 2NaI → 2NaCl + I2
Cl2 + 2NaBr → 2NaCl + Br2
Еще одно свойство: более активные галогены окисляют менее активные.
Cl2 + F2 → 2Cl + F –
В свою очередь, хлор окисляет йод. При этом в растворе образуется соляная кислота и йодная кислота:
2.4. Галогены проявляют окислительные свойства, взаимодействуют с восстановителями.
Cl2 + H2S → S + 2HCl
Хлор также окисляет сульфиты:
Также галогены окисляют пероксиды:
Или, при нагревании или на свету, воду:
2Cl2 + 2H2O → 4HCl + O2 (на свету или кип.)
Химические свойства кислорода
ри нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремнием с образованием оксидов:
1.3. Фосфор горит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
Но чаще фосфор сгорает до оксида фосфора (V):
1.4. С азотом кислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000 о С), образуя оксид азота (II):
N2 + O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca + O2 → 2CaO
Однако при горении натрия в кислороде преимущественно образуется пероксид натрия:
2Na + O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K + O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn + O2→ 2ZnO
2Fe + O2→ 2FeO
4Fe + 3O2→ 2Fe2O3
3Fe + 2O2→ Fe3O4
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
4FeS + 7O2→ 2Fe2O3 + 4SO2
Ca3P2 + 4O2→ 3CaO + P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
2H2S + 3O2→ 2H2O + 2SO2
Аммиак горит с образованием простого вещества, азота:
4NH3 + 3O2→ 2N2 + 6H2O
Аммиак окисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 + 5O2→ 4NO + 6H2O
CS2 + 3O2→ CO2 + 2SO2
2CO + O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Кислород окисляет азотистую кислоту :
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 + 2O2→ CO2 + 2H2O
2CH4 + 3O2→ 2CO + 4H2O
CH4 + O2→ C + 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
Химические свойства серы
В нормальных условиях химическая активность серы невелика: при нагревании сера активна, и может быть как окислителем, так и восстановителем.
1.1. При горении серы на воздухе образуется оксид серы (IV) :
1.2. При взаимодействии серы с галогенами (со всеми, кроме йода) образуются галогениды серы:
1.3. При взаимодействии фосфора и углерода с серой образуются сульфиды фосфора и сероуглерод:
2S + C → CS2
1.4. При взаимодействии с металлами сера проявляет свойства окислителя, продукты реакции называют сульфидами. С щелочными металлами сера реагирует без нагревания, а с остальными металлами (кроме золота и платины) – только при нагревании.
S + Fe → FeS
S + Hg → HgS
Еще пример : алюминий взаимодействует с серой с образованием сульфида алюминия:
1.5. С водородом сера взаимодействует при нагревании с образованием сероводорода:
2. Со сложными веществами сера реагирует, также проявляя окислительные и восстановительные свойства. Сера диспропорционирует при взаимодействии с некоторыми веществами.
2.1. При взаимодействии с окислителями сера окисляется до оксида серы (IV) или до серной кислоты (если реакция протекает в растворе).
Серная кислота также окисляет серу. Но, поскольку S +6 не может окислить серу же до степени окисления +6, образуется оксид серы (IV):
S + 2KClO3 → 3SO2 + 2KCl
Взаимодействие серы с сульфитами (при кипячении) приводит к образованию тиосульфатов:
2.2. При растворении в щелочах сера диспропорционирует до сульфита и сульфида.
При взаимодействии с перегретым паром сера диспропорционирует:
Химические свойства азота
При нормальных условиях азот химически малоактивен.
1.1. Молекулярный азот при обычных условиях с кислородом не реагирует. Реагирует с кислородом только при высокой температуре (2000 о С), на электрической дуге (в природе – во время грозы) :
Процесс эндотермический, т.е. протекает с поглощением теплоты.
2С + N2 → N≡C–C≡N
Этот процесс экзотермический, т.е. протекает с выделением теплоты.
1.4. Азот реагирует с активными металлами: с литием при комнатной температуре, кальцием, натрием и магнием при нагревании. При этом образуются бинарные соединения-нитриды.
2. Со сложными веществами азот практически не реагирует из-за крайне низкой реакционной способности.
Взаимодействие возможно только в жестких условиях с активными веществами, например, сильными восстановителями.
Химические свойства фосфора
При нормальных условиях фосфор довольно химически активен.
1.1. При взаимодействии с кислородом воздуха образу
ются оксиды – ангидриды соответствующих кислот :
Горение белого фосфора:
Горение красного фосфора:
1.2. При взаимодействии фосфора с галогенами образуются галогениды с общей формулой PHal3 и PHal5:
Фосфор реагирует с бромом:
1.3. При взаимодействии фосфора с серой образуются сульфиды:
1.4. При взаимодействии с металлами фосфор проявляет свойства окислителя, продукты реакции называют фосфидами.
Еще пример : натрий взаимодействует с фосфором с образованием фосфида натрия:
P + 3Na → Na3P
1.5. С водородом фосфор непосредственно не взаимодействует.
2. Со сложными веществами фосфор реагирует, проявляя окислительные и восстановительные свойства. Фосфор диспропорционирует при взаимодействии с некоторыми веществами.
2.1. При взаимодействии с окислителями фосфор окисляется до оксида фосфора (V) или до фосфорной кислоты.
Серная кислота также окисляет фосфор:
Реакция красного фосфора с бертолетовой солью. Этот процесс заложен в принципе возгорания спички при трении её о шершавую поверхность коробка.
2.2. При растворении в щелочах фосфор диспропорционирует до гипофосфита и фосфина.
Или с гидроксидом кальция:
Химические свойства углерода
При нормальных условиях углерод существует, как правило, в виде атомных кристаллов (алмаз, графит), поэтому химическая активность углерода — невысокая.
1.1. Из галогенов углерод при комнатной температуре реагирует с фтором с образованием фторида углерода:
1.2. При сильном нагревании углерод реагирует с серой и кремнием с образованием бинарного соединения сероуглерода и карбида кремния соответственно:
C + 2S → CS2
C + Si → SiC
При взаимодействии углерода с водородом образуется метан. Реакция идет в присутствии катализатора (никель) и при нагревании:
1.4. С азотом углерод реагирует при действии электрического разряда, образуя дициан:
2С + N2 → N≡C–C≡N
1.5. В реакциях с активными металлами углерод проявляет свойства окислителя. При этом образуются карбиды:
2C + Ca → CaC2
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Углерод взаимодействует со сложными веществами:
2.1. Раскаленный уголь взаимодействует с водяным паром с образованием угарного газа и водорода:
C 0 + H2 + O → C +2 O + H2 0
ZnO + C → Zn + CO
Также углерод восстанавливает железо из железной окалины:
4С + Fe3O4 → 3Fe + 4CO
При взаимодействии с оксидами активных металлов углерод образует карбиды.
3С + СаО → СаС2 + СО
2.3. Концентрированная серная кислота окисляет углерод при нагревании. При этом образуются оксид серы (IV), оксид углерода (IV) и вода:
2.4. Концентрированная азотная кислотой окисляет углерод также при нагревании. При этом образуются оксид азота (IV), оксид углерода (IV) и вода:
Химические свойства кремния
При нормальных условиях кремний существует в виде атомного кристалла, поэтому химическая активность кремния крайне невысокая.
1.1. При обычных условиях кремний реагирует с фтором с образованием фторида кремния (IV):
При нагревании кремний реагирует с хлором, бромом, йодом :
1.2. При сильном нагревании (около 2000 о С) кремний реагирует с углеродом с образованием бинарного соединения карбида кремния (карборунда):
C + Si → SiC
При температуре выше 600°С взаимодействует с серой:
Si + 2S → SiS2
1.4. С азотом кремний реагирует в очень жестких условиях:
1.5. В реакциях с активными металлами кремний проявляет свойства окислителя. При этом образуются силициды:
2Ca + Si → Ca2Si
Si + 2Mg → Mg2Si
1.6. При нагревании выше 400°С кремний взаимодействует с кислородом :
2. Кремний взаимодействует со сложными веществами:
2.1. В водных растворах щелочей кремний растворяется с образованием солей кремниевой кислоты. При этом щелочь окисляет кремний.
2.2. Кремний не взаимодействует с водными растворами кислот, но аморфный кремний растворяется в плавиковой кислоте с образованием гексафторкремниевой кислоты:
При обработке кремния безводным фтороводородом комплекс не образуется:
С хлороводородом кремний реагирует при 300 °С, с бромоводородом – при 500 °С.
2.3. Кремний растворяется в смеси концентрированных азотной и плавиковой кислот :
3Si + 4HNO3 + 12HF → 3SiF4 + 4NO + 8H2O