С чем связана разная окраска коллоидных растворов
Окраска коллоидных растворов
Многие коллоидные системы имеют определенную окраску, что указывает на поглощение ими света соответствующей части спектра.
Золь окрашен в цвет, дополнительный поглощенному. Если поглощение отсутствует, золь будет прозрачным или белым. Если все компоненты падающего света поглощаются, то суммарный цвет будет черным. Поглощая синюю часть (435 – 480 нм) видимого спектра (400 – 760 нм), золь будет жёлтого цвета. Поглощая синевато-зелёную часть (490 – 500 нм) видимого спектра, окраска золя красная.
Золь с металлическими частицами сильно поглощает свет. Это обусловлено генерацией в частицах электрического тока, часть энергии которого переходит в теплоту. Для золей металлов характерна селективность поглощения, зависит от дисперсности. С ростом дисперсности максимальное поглощение смещается в сторону коротких волн.
Интенсивность окраски золя зависит от размера частиц. Она максимальна при средних размерах частиц ультрамикрогетерогенной системы и уменьшается как при увеличении, так и при уменьшении дисперсности. Для гидрозоля золота самая яркая окраска соответствует размеру частиц при радиусе от 20 до 37 нм. Окраска многих минералов и драгоценных камней обусловлена наличием в них высокодисперсных частиц металлов и их оксидов. Например, рубиновое стекло содержит 0,01 – 0,1 % золота с размером частиц 4 – 30 мкм, рубин – это Cr2O3, диспергированный в Al2O3.
Оптические методы исследования коллоидных систем являются наиболее распространенными методами определения размера, формы и структуры коллоидных систем. Наиболее часто применяются:
2) электронная микроскопия;
4) определение двойного лучепреломления в потоке;
Урок №13. Коллоидные растворы
Дисперсные системы
Чистые вещества в природе встречаются очень редко. Смеси разных веществ в различных агрегатных состояниях могут образовывать гетерогенные и гомогенные системы — дисперсные системы и растворы.
Дисперсными называют гетерогенные системы, в которых одно вещество в виде очень мелких частиц равномерно распределено в объеме другого.
И дисперсионную среду, и дисперсную фазу могут представлять вещества, находящиеся в различных агрегатных состояниях — твердом, жидком и газообразном.
В зависимости от сочетания агрегатного состояния дисперсионной среды и дисперсной фазы можно выделить 9 видов таких систем.
Уже беглое знакомство с дисперсными системами и растворами показывает, насколько они важны в повседневной жизни и в природе.
Судите сами: без нильского ила не состоялась бы великая цивилизация Древнего Египта; без воды, воздуха, горных пород и минералов вообще бы не существовала живая планета — наш общий дом — Земля; без клеток не было бы живых организмов и т. д.
Классификация дисперсных систем и растворов
Взвеси
Взвеси — это дисперсные системы, в которых размер частиц фазы более 100 нм. Это непрозрачные системы, отдельные частицы которых можно заметить невооруженным глазом. Дисперсная фаза и дисперсионная среда легко разделяются отстаиванием. Такие системы разделяют на:
1) эмульсии (и среда, и фаза — нерастворимые друг в друге жидкости). Это хорошо известные вам молоко, лимфа, водоэмульсионные краски и т. д.;
2) суспензии (среда — жидкость, а фаза — нерастворимое в ней твердое вещество). Это строительные растворы (например, «известковое молоко» для побелки), взвешенный в воде речной и морской ил, живая взвесь микроскопических живых организмов в морской воде — планктон, которым питаются гиганты-киты, и т. д.;
3) аэрозоли — взвеси в газе (например, в воздухе) мелких частиц жидкостей или твердых веществ. Различают пыли, дымы, туманы. Первые два вида аэрозолей представляют собой взвеси твердых частиц в газе (более крупные частицы в пылях), последний — взвесь мелких капелек жидкости в газе. Например, природные аэрозоли: туман, грозовые тучи — взвесь в воздухе капелек воды, дым — мелких твердых частиц. А смог, висящий над крупнейшими городами мира, также аэрозоль с твердой и жидкой дисперсной фазой. Жители населенных пунктов вблизи цементных заводов страдают от всегда висящей в воздухе тончайшей цементной пыли, образующейся при размоле цементного сырья и продукта его обжига — клинкера. Аналогичные вредные аэрозоли — пыли — имеются и в городах с металлургическими производствами. Дым заводских труб, смоги, мельчайшие капельки слюны, вылетающие изо рта больного гриппом, также вредные аэрозоли.
Аэрозоли играют важную роль в природе, быту и производственной деятельности человека. Скопления облаков, обработка полей химикатами, нанесение лакокрасочных покрытий при помощи пульверизатора, распыление топлив, выработка сухих молочных продуктов, лечение дыхательных путей (ингаляция) — примеры тех явлений и процессов, где аэрозоли приносят пользу. Аэрозоли — туманы над морским прибоем, вблизи водопадов и фонтанов, возникающая в них радуга доставляет человеку радость, эстетическое удовольствие.
Для химии наибольшее значение имеют дисперсные системы, в которых средой является вода и жидкие растворы.
Природная вода всегда содержит растворенные вещества. Природные водные растворы участвуют в процессах почвообразования и снабжают растения питательными веществами. Сложные процессы жизнедеятельности, происходящие в организмах человека и животных, также протекают в растворах. Многие технологические процессы в химической и других отраслях промышленности, например получение кислот, металлов, бумаги, соды, удобрений, протекают в растворах.
Коллоидные системы
Коллоидные системы — это такие дисперсные системы, в которых размер частиц фазы от 100 до 1 нм. Эти частицы не видны невооруженным глазом, и дисперсная фаза и дисперсионная среда в таких системах отстаиванием разделяются с трудом.
Их подразделяют на золи (коллоидные растворы) и гели (студни).
Коллоидные растворы могут быть получены в результате химических реакций; например, при взаимодействии растворов силикатов калия или натрия («растворимого стекла») с растворами кислот образуется коллоидный раствор кремниевой кислоты. Золь образуется и при гидролизе хлорида железа (Ш) в горячей воде. Коллоидные растворы внешне похожи на истинные растворы. Их отличают от последних по образующейся «светящейся дорожке» — конусу при пропускании через них луча света.
С чем связана разная окраска коллоидных растворов
§ 57. Коллоидные растворы
На примере кремниевой кислоты нам предстоит познакомиться с особым видом растворов, которые получили название коллоидных растворов.
Рис. 44. Молоко под микроскопом
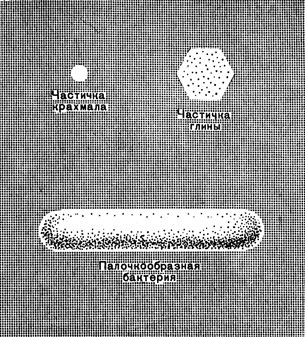
Рис. 45. Сравнительные размеры коллоидных частиц
или в ионной форме:
Яичный белок тоже коллоидный раствор. Клей, желатин, крахмал при нагревании с водой тоже образуют коллоидные растворы. Слово «коллоид» произошло от греческого названия клея «колла» и означает «подобный, клею».
Как распознавать коллоидные растворы, если они так же прозрачны, как истинные растворы? Взвешенные частички в коллоидном растворе можно обнаружить подобно тому, как обнаруживается присутствие пылинок в комнатном воздухе. Когда в темную комнату проникает сквозь щель солнечный луч, то, глядя сбоку, его можно увидеть в виде светлой «дорожки», образованной рассеивающими свет пылинками. Точно так же, если в затененном помещении пропускать световой луч через коллоидный раствор, например полученной нами гидроокиси железа, и глядеть на раствор сбоку, то путь луча в растворе можно наблюдать в виде такой же светлой «дорожки» вследствие рассеяния света коллоидными частичками (рис. 46). При прохождении светового луча через истинный раствор (например, сахара или поваренной соли) такого явления не наблюдается, хотя бы раствор имел окраску: содержащиеся в истинных растворах молекулы или ионы слишком малы и заметно не рассеивают света. Однако резкой границы ни между взвесями и коллоидными растворами, ни между коллоидными и истинными растворами нет. Известны вещества, например белки, молекулы которых настолько крупны, что они образуют коллоидные растворы, хотя и находятся в них в состоянии молекулярного раздробления.
Рис. 46. Прохождение луча света через коллоидный (а) и через истинный (б) растворы
Коллоидные частички, сколько бы времени раствор ни стоял в покое, не оседают на дно сосуда. Они находятся в постоянном движении вследствие беспрерывных ударов о них молекул растворителя. Это препятствует их осаждению.
Соединение коллоидных частичек в более крупные частицы называется коагуляцией. Чем больше заряд адсорбирующихся ионов, тем меньшая концентрация их достаточна, чтобы вызвать коагуляцию.
Часто при коагуляции коллоидные растворы образуют обычные осадки, но иногда не происходит отделения коллоидных частиц от растворителя, а коллоидный раствор весь превращается в полутвердую упругую массу, называемую студнем, как это происходит при застудневании крахмального клейстера (киселя) или раствора желатина при образовании желе.; Студень получается также при коагуляции клея. Студень клея при испарении из него воды все более твердеет и может прочно склеивать предметы. При варке яиц вкрутую тоже происходит коагуляция белков, приводящая к образованию студня. То же самое происходит с белками крови при ее свертывании.
В природе коагуляция происходит, например, когда пресные воды рек, несущие разнообразные вещества в коллоидном состоянии, встречаются с морской водой, богатой солями. Вследствие коагуляции коллоидов в устьях рек образуются отложения ила и появляются мели.
Коллоидные растворы играют важную роль в природе и в производстве. Коллоидными растворами богаты почвы, и явления, происходящие в этих растворах, влияют на плодородие почв. Протоплазма всех живых клеток, кровь представляют собой коллоидные растворы. С получением коллоидных растворов, их коагуляцией, образованием студней связаны также промышленные процессы, как изготовление клеев, лаков, крашение тканей, дубление кож, получение искусственных волокон и т. д.
Холодный утренний туман, оседающий на землю, столб дыма над костром, взвешенные частицы в воде рек и озер — все это мы видели множество раз.
Нас постоянно окружают дисперсные системы
Понимание коллоидных систем важно для общего понимания образования гидроокиси железа в водоочистке и принципов фильтрации. Этот старый советский обучающий фильм отлично рассказывает о том, что такое коллоиды, как они образуются и взаимодействуют с окружающей средой. СМОТРИМ! Если смотреть не получается — читаем.
Они состоят из вещества в мелкораздробленом состоянии — дисперсной фазы и среды в которой эта фаза распределеа и которую называют дисперсионной средой.
Величина частиц и степень их дисперсности может быть различной. Сравнительно большие размеры частиц имеют грубодисперсные системы — взвеси и эмульсии.
В истинных растворах вещество находится в виде молекул или оинов распределенных равномерно среди молекул растворителя.
Частицы грубодисперсных систем хорошо видны в микроскоп. Например, молоко, представляющее эмульсию капелек жира в сыворотке, дым — это множество твердых частиц, взвешенных в воздухе.
Грубодисперсные системы неустойчивы и со временем дисперсная фаза отделяется от дисперсионной среды (выпадает в осадок).
По размеру частиц промежуточной положение между истинными растворами и взвесями занимают коллоидные растворы — золи.
Коллоидные частицы очень малы. И все же они могут состоять из сотен и тысяч молекул.
Свойства коллоидных растворов
Коллоидные частицы настолько малы, что не видны в обычный микроскоп. По внешнему виду коллоидный раствор нельзя отличить от истинного. Однако, если на освещенный коллоидный раствор посмотреть сбоку, то свет луча будет виден, как светлая дорожка, образовавшаяся от рассеивания света частицами. Это явление используют для распознавания коллоидных растворов.
В истинном растворе свет луча не виден, так как молекулы и ионы истинного раствора слишком малы и не рассеивают его.
В коллоидном — свет хорошо заметен. Он образует так называемый конус Тиндаля. Частицы коллоидных растворов под уадарами молекул растворителя совершают непрерывные хаотические перемещения. Это явление носит название Броуновского движения.
Из-за очень малых размеров коллоидные частицы имеют огромную суммарную поверхность.
Поверхность кубика с длинной ребра в 1 см составляет всего 6 квадратных сантиметров.. Но если 1 кубический сантиметр вещества раздробить на части объемом в 1 кубический микрон, то общая их поверхность увеличится в 10 тысяч раз. Поэтому и поглотительные свойства у коллоидных частиц проявляются значительно сильнее, чем у нераздробленного вещества.
Оптические свойства коллоидов/методическая разработка/
Тема: Оптические свойства коллоидов
По оптическим свойствам коллоидные растворы существенно отличаются от истинных растворов низкомолекулярных веществ, а также и от грубодисперсных систем. Наиболее характерными оптическими свойствами коллоидных растворов являются опалесценция, эффект Фарадея — Тиндаля и окраска. В основе этих свойств лежит рассеяние и поглощение света коллоидными частицами.
Опалесценция. С явлением рассеяния света коллоидными частицами связана опалесценция. Выражается она в появлении некоторой мутноватости и в изменении окраски золя в проходящем и отраженном свете. Так, например, водные золи серы, канифоли и хлорида серебра в проходящем свете имеют красновато-желтый оттенок, а в отраженном (т. е. при наблюдении сбоку) — голубоватый. Цвет опалесценции золей преимущественно голубой (голубой цвет разбавленного водой молока, синий цвет морской волны, табачного дыма). Объясняется это тем, что желтые и красные лучи (с большой длиной волн) мало рассеиваются и проходят через систему, а голубые и синие (с меньшей длиной волн) хорошо рассеиваются.
Ультрамикроскопия. На явлении рассеивания света коллоидными частицами основаны два важнейших метода их исследования: ультрамикроскопия и нефелометрия.
Нефелометрия. На явлении светорассеяния основан метод определения концентрации и степени дисперсности коллоидных систем — нефелометрия.
Цель: определение о птическ ого свойства коллоидов с помощью микроскопа с конденсором темного поля.
Методические указания: внимательно ознакомьтесь с содержанием лабораторной работы, определите объем и последовательность хода работы. Прочитайте цель урока, проверьте наличие оборудования и реактивов. Подготовьте запись хода опытов, а затем приступайте к их выполнению. По окончании лабораторной работы заполните журнал по лабораторной работе в соответствии с требованиями опытов.
Вопросы для повторения.
1.Что такое опалесценция? Чем опаласценция отличается от флуоресценции?
2. На чем основан седиментационный метод анализа?
3. Что такое ультрамикроскопия и нефелометрия?
Опыт №1. Наблюдение золей с помощью микроскопа с конденсором темного поля.
Выполнение опыта. На предметное стекло наносят 1-2 капли разбавленного золя иодида серебра и накрывают их покровным стеклом, но так, чтобы под ним не осталось пузырьков воздуха. Оба стекла должны быть перед опытом тщательно вымыты и вытерты.
Предметное стекло помещают на столик микроскопа, предварительно нанеся на него 1-2 капли иммерсионной жидкости (обычно глицерин). На микроскопе устанавливают объектив с малым увеличением. Расстояние между объективом и покровным стеклом должно быть равно примерно одному сантиметру. Поворачивая осветительное зеркало микроскопа, добиваются хорошего освещения объекта (синее поле зрения). Затем микрометрическим винтом фокусируют микроскоп до появления в поле зрения ярких движущихся частиц. Регулируя освещение, добиваются наибольшей яркости частиц. Далее рассматривают систему с объективом большего увеличения, нанося на покровное стекло 1-2 капли иммерсионной жидкости, и снова осторожно фокусируют.