субфебрилитет неуточненный код мкб
Лихорадка неуточненная
Рубрика МКБ-10: R50.9
Содержание
Определение и общие сведения [ править ]
На состояние температуры тела влияют обусловленные разными причинами изменения теплопродукции и теплоотдачи. Если температура тела повышается до 39 °С, больные обычно испытывают недомогание, сонливость, слабость, головную и мышечные боли. При температуре выше 41,1 °С у детей часто возникают судороги. Если температура повышается до 42,2 °С и выше, то становится возможным возникновение необратимых изменений в ткани мозга, по-видимому, вследствие денатурации белков. Температура выше 45,6 °С несовместима с жизнью.
Этиология и патогенез [ править ]
При нарушении функции терморегуляторного центра в преоптической области гипоталамуса (сосудистые расстройства, чаще кровоизлияния, энцефалит, опухоли) возникает эндогенная центральная гипертермия. Для нее характерны изменения суточных колебаний температуры тела, прекращение потоотделения, отсутствие реакции при приеме антипиретических препаратов, нарушение терморегуляции, в частности выраженность снижения температуры тела в ответ на его охлаждение.
Кроме гипертермии, обусловленной нарушением функции терморегуляторного центра, повышенная теплопродукция может быть связана и с другими причинами. Она возможна, в частности, при тиреотоксикозе (температура тела может быть выше нормальной на 0,5-1,1 °С), при повышенной активации мозгового вещества надпочечников, менструациях, климаксе и других состояниях, сопровождающихся эндокринным дисбалансом. Гипертермию может обусловить и чрезвычайная физическая нагрузка. Например, при беге на марафонскую дистанцию температура тела иногда повышается до 39-41 °С. Причиной гипертермии может быть и снижение теплоотдачи. В связи с этим она возможна при врожденном отсутствии потовых желез, ихтиозе, распространенных ожогах кожи.
Вариантом психогенной лихорадки можно, по-видимому, признать синдром Хайнса-Бенника (описал M. Hines-Bannick), возникающий как следствие вегетативного дисбаланса, проявляющегося общей слабостью (астенией), перманентной гипертермией, выраженным гипергидрозом, «гусиной» кожей. Может быть спровоцирован психической травмой.
Клинические проявления [ править ]
Лихорадка неуточненная: Диагностика [ править ]
Дифференциальный диагноз [ править ]
Лихорадка неуточненная: Лечение [ править ]
Профилактика [ править ]
Прочее [ править ]
Температурные кризы (пароксизмальная неинфекционная гипертермия)
Внезапные повышения температуры до 39-41 °С, сопровождающиеся ознобоподобным состоянием, ощущением внутреннего напряжения, гиперемией лица, тахикардией. Повышенная температура сохраняется несколько часов, после чего обычно возникает ее литическое снижение, сопровождающееся общей слабостью, разбитостью, отмечаемыми в течение нескольких часов. Кризы могут возникать на фоне нормальной температуры тела или длительного субфебрилитета (перманентно-пароксизмальная гипертермия). При них нехарактерны изменения крови, в частности ее лейкоцитарной формулы. Температурные кризы являются одним из возможных проявлений вегетативной дистонии и дисфункции терморегуляторного центра, входящего в состав гипоталамических структур.
Для лечения больных с неинфекционной гипертермией целесообразно применение бета или альфа-адреноблокаторв (фентоламин 25 мг 2-3 раза в день, пирроксан 15 мг 3 раза в день), общеукрепляющее лечение. При устойчивой брадикардии, спастической дискинезии назначают препараты белладонны. Больному следует отказаться от курения и злоупотребления алкоголем.
Лихорадка неясного генеза
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Иногда встречаются случаи, когда у пациента повышается температура тела (более 38° C) практически на фоне полного здоровья. Такое состояние может быть единственным признаком заболевания, причем многочисленные исследования не позволяют определить какую-либо патологию в организме. В данной ситуации врач, как правило, ставит диагноз – лихорадка неясного генеза, и после этого назначает более детальное обследование организма.
Код МКБ 10
Лихорадка невыясненной этиологии R50 (кроме родовой и послеродовой лихорадки, а также лихорадки новорожденных).
Код по МКБ-10
Причины лихорадки неясного генеза

Симптомы лихорадки неясного генеза
Основным (зачастую и единственным) присутствующим признаком лихорадки неясного генеза считается повышение температурных показателей. На протяжении длительного периода повышение температуры может наблюдаться без сопутствующих симптомов, либо протекать с ознобом, усиленным потоотделением, кардиологическими болями, одышкой.
Температурные показатели могут быть различными, в зависимости от типа лихорадки:
Длительная лихорадка неясного генеза может быть:
Лихорадка неясного генеза у детей
Повышенная температура у ребенка – наиболее распространенная проблема, с которой обращаются к педиатру. Но какую именно температуру у детей следует считать лихорадкой?
Врачи отделяют лихорадку от просто высокой температуры, когда показатели превышают 38°C у грудных детей, и выше 38,6°C – у старших детей.
У большей части маленьких пациентов лихорадка бывает связана с вирусной инфекцией, меньший процент детей болеют воспалительными заболеваниями. Часто такие воспаления затрагивают мочевыводящую систему, либо наблюдается скрытая бактериемия, что в дальнейшем может осложниться сепсисом и менингитом.
Чаще всего возбудителями микробных поражений в детском возрасте становятся такие бактерии:
Наиболее часто микробные инфекции поражают детей в первое полугодие жизни: особенно подвержены таким заболеваниям недоношенные новорожденные.

Диагностика лихорадки неясного генеза
По результатам лабораторных анализов:
По результатам инструментальных исследований:
Алгоритм диагностики лихорадки неясного генеза вырабатывается доктором в индивидуальном порядке. Для этого у пациента определяется хотя бы один дополнительный клинический или лабораторный симптом. Это может быть заболевание суставов, пониженный уровень гемоглобина, увеличение лимфатических узлов и пр. Чем больше будет обнаружено таких вспомогательных признаков, тем легче будет установить правильный диагноз, сузив круг предполагаемых патологий и определяя целенаправленную диагностику.

Дифференциальная диагностика лихорадки неясного генеза
Дифференциальный диагноз, как правило, разделяют на несколько основных подгруппы:
При дифференциации обращают внимание не только на симптомы и жалобы пациента на данную минуту, но и на те, которые были до этого, но уже пропали.
Необходимо брать во внимание все болезни, которые предшествовали лихорадке, в том числе и оперативные вмешательства, травмы, психоэмоциональные состояния.
Важно уточнить наследственные особенности, возможность приема каких-либо лекарственных средств, тонкости профессии, недавние путешествия, информацию о сексуальных партнерах, о присутствующих дома животных.
В самом начале диагностики необходимо исключить преднамеренность лихорадочного синдрома – не так уж редко встречаются случаи задуманного введения пирогенных средств, манипуляций с градусником.
Большое значение имеют кожные высыпания, проблемы с сердцем, увеличение и болезненность лимфоузлов, признаки нарушений глазного дна.

Лихорадка без очага инфекции у детей
14-16 октября, Алматы, «Атакент»
150 участников из 10 стран. Новинки рынка стоматологии. Цены от производителей
Общая информация
Краткое описание
Союз педиатров России
Клинические рекомендации: Лихорадка без очага инфекции у детей
МКБ 10: А49.8/ A49.9/ R50.0/ R50.1
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Этиология и патогенез
Эпидемиология
Диагностика
Сбор анамнеза имеет цель предположить очаг бактериальной инфекции или наличие катаральных явлений: необходим тщательный сбор анамнеза с выяснением, в том числе, предшествующих заболеваний ребенка и применявшееся лечение, случаи заболевания в семье (включая социально-значимые инфекции) и коллективе, жалоб, вакцинального статуса и результатов проведенных туберкулиновых проб.
• Дети 3-6 месяцев жизни с нарушением общего самочувствия.
• Рекомендовано в осмотр включать измерение роста и массы тела, температуры тела, оценку состояния костно-суставной системы; выявление признаков геморрагического синдрома, гепатоспленомегалии, лимфаденопатии, аускультацию сердца и легких.
| Общее самочувствие удовлетворительное, ребенок «не токсичен» | Состояние средней степени тяжести | Состояние тяжелое, ребенок «токсичный» | ||||||||||||||||||||||||||||||||||||||||||||||
| Ответ на внешние раздражители, активность | ||||||||||||||||||||||||||||||||||||||||||||||||
| Цвет кожи и слизистых оболочек/микроциркуляция | Нормальный цвет губ, языка и кожи | Бледность, по мнению родителей | • У детей первых 3-х месяцев жизни с лихорадкой клинические признаки интерпретировать достаточно сложно. Для оценки риска тяжелой бактериальной инфекции рекомендовано использовать Рочестерские критерии [10] (табл. 2). Несмотря на то, что немалая часть ЛБОИ вызвана вирусными инфекциями, необходимо помнить, что в 5% случаев ТБИ протекает с вирусной ко-инфекцией. Поэтому выделение вируса даже методом ПЦР не исключает наличия бактериальной инфекции, более того, чем младше ребенок, тем выше риск бактериемии и ТБИ [9]. Также доказано, что более чем в 70% случаев у детей с ЛБОИ методом ПЦР выделяется один и более вирусов (в образцах крови и/или назофарингеальном смыве), что не определяет их роли в развитии настоящего заболевания. По данным большинства исследований, определение уровня ПКТ дает более точные результаты при диагностике ТБИ и бактериемии по сравнению с уровнем СРБ и с уровнем лейкоцитов, при этом низкий уровень ПКТ выше коррелирует с отсутствием бактериальной инфекции, нежели высокий уровень с ее наличием. Комментарии: люмбальная пункция обязательна при выявлении менингеальной симптоматики. Однако такие дети, как правило, не попадают в группу ЛБОИ [3,9]. — расширение крыльев носа во время дыхания [3]. Лечение— иных признаков заболевания – тактика в зависимости от новых симптомов (стоматит, гингивит – введение ацикловира, сыпь – вероятна энтеровирусная инфекция). Комментарии: лечение ЛБОИ направлено, прежде всего, на подавление бактериальной инфекции. Доказано, что введение цефтриаксона в дозе 50 мг/кг детям с ЛБОИ с признаками бактериемии существенно снижает частоту развития и прогрессирования бактериальной инфекции [16]. Назначение пероральных антибактериальных препаратов не снижает частоту развития менингита [17], поэтому их назначение ненадежно. (Сила рекомендаций – 1; достоверность доказательств – В) ПрогнозПрогноз серьезный при отсутствии лечения и развитии менингита, сепсиса, пневмонии.
ПрофилактикаК профилактическим мерам борьбы с ЛБОИ относится вакцинация. Доказано, что вакцинация против гриппа существенно сокращает частоту ЛБОИ [2]. После массового введения вакцинации против гемофильной палочки частота гемофильной бактериемии у детей с ЛБОИ снизилась до 1-2 % [1], при вакцинации против пневмококковой инфекции риск развития пневмококковой бактериемии снижается на 84%, а также всех случаев бактериемии – на 69% у детей в возрасте до 4-х лет [16]. Современные представления о периодической болезни и клинические рекомендации по диагностике и лечениюВ статье представлены современные сведения о патогенезе, клинических проявлениях, диагностике и лечении периодической болезни. Обсуждаются клинические и лабораторные методы оценки активности заболевания и подходы к лечению больных, резистентных к колхицину, на основе подавления эффектов интерлейкина-1. Периодическая болезнь (ПБ), более известная в англоязычной литературе под названием Средиземноморская лихорадка, является древнейшим заболеванием. Первые наблюдения ПБ были описаны еще на закате средневековья. Так, H. Reimann указывает, что в 1629 г. Aubrey сообщил о своем страдании, которое проявлялось ознобом, тошнотой, рвотой, болями в животе, длящимися до полусуток и возникающими сначала каждые 2 недели, позже ежемесячно, один раз в 3 месяца, один раз в полгода [1]. Как самостоятельная нозологическая единица ПБ была выделена только в середине ХХ столетия. В 1948 г. H. Reimann на основании 6 наблюдений объединил общим термином “периодическая болезнь” ряд синдромов, включающих периодическую лихорадку, доброкачественный пароксизмальный перитонит, циклическую нейтропению и перемежающуюся артралгию [2]. Основными критериями считали периодичность и доброкачественность течения. По этой причине понятие “периодическая болезнь” стало очень широким. Благодаря работам E. S):1–112. ohar и соавт. (1967) [3], а в нашей стране – О.М. Виноградовой (1964, 1973) [4], В.А. Аствацатрян и соавт. [5] клиническая картина ПБ была очерчена более отчетливо. После открытия гена MEFV, мутации которого приводят к развитию клинических проявлений ПБ, были сформулированы окончательные критерии ПБ. Тем не менее, сохраняет актуальность выделение особого обобщающего термина для всех периодических синдромов, клинические проявления и принципы диагностики которых сходны. Учитывая их наследственный характер, широко применяется термин семейные периодические лихорадки, которые, помимо ПБ, включают в себя криопиринопатии (семейная холодовая крапивница, синдром Макла-Уэллса, NOMID-CINCA синдром), гипериммуноглобулинемию D (дефицит мевалонаткиназы), TRAPS):1–112. (синдром, обусловленный мутацией гена рецептора к фактору некроза опухоли [ФНО]-α) и некоторые другие. Все эти заболевания характеризуются беспричинно повторяющимися приступами лихорадки в сочетании с воспалением кожи, серозных оболочек и суставов [4]. В основе патогенеза ведущую роль играют генетически детерминированные нарушения врожденного иммунитета, а механизмы специфического иммунитета – гуморального, связанного с синтезом аутоантител, и Т-клеточного, не имеют значения [5]. Клиническое предположение о наличии этих синдромов может возникать преимущественно у молодых пациентов с приступами болей в животе, грудной клетке в сочетании с афтозным стоматитом, диареей при наличии подобных признаков у родственников (табл. 1) [8]. Для оценки риска семейных периодических лихорадок предложен специальный индекс [9], автоматизированный расчет которого, предлагается на сайте Eurofever Project (https://www.printo.it/eurofever/index. asp). Паци ен там с высоким риском следует проводить генетическое тестирование для исключения семейных периодических лихорадок. У выходцев из Средиземно морья и Кавказа с непродолжительными приступами (менее 3 дней) в первую очередь следует исключать ПБ, у остальных пациентов с длительностью приступов до недели и эпизодами рвоты следует думать о дефиците мавалонаткиназы с развитием гипериммуноглобулинемии D, приступы длительностью более недели являются основанием для исключения TRAPS):1–112. (рис. 1). У пациентов с низким риском предлагается наблюдение за течением болезни с последующим повторным обсуждением показаний к генетическому исследованию на семейные периодические лихорадки. Эпидемиология периодической болезниОдним из признаков наследственной природы ПБ является этноассоциированный характер болезни – ее широкое распространение у народов, проживающих в бассейне Средиземного моря – армян, евреев-сефардов и, реже, арабов, турков, была показана разными авторами на больших группах больных. По данным О.М. Ви но градовой лица других национальностей среди больных ПБ встречались лишь в 2% случаев [4]. Среди 86 носителей гена ПБ, наблюдавшихся J. S):1–112. amuels и соавт. [10], необычно высоким было число итальянцев и евреев-ашкенази. Однако и в этой группе 96% пациентов оказались представителями средиземноморской популяции. В группе из 150 больных ПБ, обследованных О.М. Виноградовой [4], 88,6% составили армяне. В последние годы эту болезнь на территории России широко диагностируют у азербайджанцев, представителей разных народов Северного Кавказа, имеются также отдельные наблюдения ПБ среди русских и украинцев, преимущественно жителей южных регионов России. Болезнь наследуется по аутосомно-рецессивному пути. Это означает, что у родителей симптомы заболевания обычно отсутствуют, однако в больших семьях болезнь может проявиться у родных или двоюродных братьев/ сестер, дяди или дальнего родственника. Ген, ответственный за ПБ, был клонирован в 1997 году и обозначен аббревиатурой MEFV (MEditerranean FEver) [11,12], в том же году были идентифицированы 8 основных мутаций гена. Ген MEFV располагается на коротком плече 16 хромосомы центромерно к гену гемоглобина- α, рядом с генами, ответственными за аутосомно-доминантный поликистоз почек и туберозный склероз 13. Показано, что среди евреев-сефардов, выходцев из Испании, частота носительства MEFV составляет от 1:16 до 1:8 (при распространенности ПБ в этой популяции от 1:250 до 1:1000) [15]. Частота носительства среди евреев-ашкенази Южной Европы почти на 2 порядка ниже – 1:135 (при распространенности ПБ 1:73000). Частота носительства среди американских армян составляет 1:7 [16]. Причина сохранения в современной средиземноморской популяции высокой частоты носительства MEFV остается неясной, однако сочетание ее с многочисленностью аллелей MEFV может свидетельствовать в пользу благоприятных условий для естественного отбора гетерозигот-носителей этих аллелей, по аналогии с распространенностью гена серповидноклеточной анемии в эндемичных очагах малярии. Клиническая картина и диагнозПродуктом MEFV является белок пирин, или маренострин (от латинского Mare Nostrum – Средиземное море) [11,12]. Одним из отличительных свойств пирина является наличие В30.2-домена. Кроме того, в молекуле пирина обнаружены 2 локуса потенциального связывания с ядром, а α-спиральный и В-box-домены могут обеспечивать взаимодействие с другими белками. Все выявленные в настоящее время мутации, ассоциирующиеся с ПБ, касаются изменений в В30.2-зоне пирина. Экспрессия MEFV происходит почти исключительно в гранулоцитах и не наблюдается в лимфоцитах и моноцитах [11]. Не обнаруживают экспрессию гена и в других тканях. Согласно основной в настоящее время рабочей гипотезе пирин является базовым регулятором воспалительного ответа нейтрофилов. Соответ ственно, структурные изменения в молекуле пирина могут изменить функцию контроля и способствовать постоянному провоспалительному потенциалу нейтрофилов. Немутантный пирин ингибирует адапторный белок AS):1–112. C, который кроме участия в апоптозе формирует ядро инфламмасомного комплекса путем гомотипического взаимодействия с белком NLRP и каспазой, что ведет к активации интерлейкина (ИЛ)-1 β. Инфламма сома – макромолекулярная платформа в цитоплазме, устойчивая к внутриклеточным механизмам деградации белков и, в силу этого, способная обеспечить реализацию провоспалительной активности клетки. Суще ствует несколько разновидностей инфламмасом. При ПБ и других семейных периодических лихорадках основное значение придают инфламмасоме на основе белка NLRP3 – криопирина. В качестве основной причины развития ПБ рассматривают утрату ингибиторного эффекта мутантного пирина на AS):1–112. C и, как следствие, активацию каспазы-1 [17], либо формирование пирином собственной инфламмасомы [18]. Однако роль мутаций домена B30.2 в развитии ПБ остается спорной; возможно, пирин может проявлять как про-,так и противовоспалительные свойства в зависимости от конкретных условий. Значение мутантного пирина в усилении секреции ИЛ-1 β при ПБ подтверждается купированием приступа ПБ при парентеральном введении ингибиторов ИЛ-1 [19]. Таким образом, в настоящее время несомненным диагностическим критерием ПБ является выявление гомозиготного носительства мутаций пирина. Однако у 20% больных клинические признаки ПБ развиваются при наличии только одной мутации. У таких пациентов сохраняют диагностическое значение клинические критерии болезни, в частности эффективность колхицина. Окончательный диагноз в этом случае может быть установлен только через 6-12 месяцев наблюдения за эффектом колхицина. Важное значение имеет осмотр пациента во время периодических приступов заболевания, которые проявляются лихорадкой в сочетании с абдоминалгиями, торакалгиями, артралгиями и другими, более редкими, проявлениями. Указанные проявления могут возникать в различных сочетаниях или с разной периодичностью, обычно выделяют абдоминальный, торакальный, лихорадочный, реже суставной варианты ПБ. Болезнь возникает преимущественно в детском или юношеском возрасте, чаще у мужчин, и характеризуется хроническим течением с обострениями и ремиссиями, возникающими от разнообразных причин и через различные сроки. Между приступами болезненные проявления отсутствуют, а во время приступа болезни многие пациенты сохраняют работоспособность. Приступы продолжаются от 12 ч до 3 суток, а затем самостоятельно разрешаются. Продолжительность межприступного периода у одного и того же пациента составляет от нескольких дней до нескольких месяцев, иногда приступы следуют один за другим с промежутками в 1-3 дня, но возможны и длительные ремиссии до нескольких лет. Характерный признак болезни, имеющий диагностическое значение, – стереотипность приступов. Пациенту, как правило, без труда удается отличить боль и лихорадку, вызванные приступом болезни, от подобных симптомов другого генеза. Лихорадка, которая у нелеченных больных, как правило, достигает высоких значений и сопровождается потрясающими ознобами, является практически постоянным симптомом приступа. Выделение особой лихорадочной формы болезни обосновывается тем, что другие симптомы, включая абдоминалгии, встречаются реже. Однако В.М. Арутюнян и соавт. полагают, что острый асептический серозит, хотя бы и кратковременный, является облигатным проявлением болезни, в связи с чем нецелесообразно расширять классификацию болезни за счет лихорадочной и суставной форм, а достаточно ограничиться тремя формами – абдоминальной, торакальной и смешанной [20]. Абдоминальный вариант наблюдается у 91% больных [11,12]. В основе абдоминального варианта ПБ лежит рецидивирующее доброкачественное воспаление серозной оболочки брюшной полости с преобладанием экссудативной реакции над пролиферативной, что подтверждается малым количеством спаек, несмотря на частоту приступов. В воспалительный процесс вовлекаются брыжейка, серозная оболочка кишки, печени, селезенки, диафрагмы. Абдоминалгии обычно сопровождаются симптомами раздражения брюшины и вялой перистальтикой, что наряду с лихорадкой и лейкоцитозом периферической крови создает существенные дифференциально-диагностические сложности и ведет к необоснованной лапаротомии. Торакальный вариант, в основе которого лежит асептический плеврит, наблюдается у 57% пациентов [11, 12]. При рентгеноскопии грудной клетки во время приступа отмечают ограничение подвижности купола диафрагмы, небольшой выпот в синусе над диафрагмой, реже дисковидные ателектазы, все эти явления затем полностью исчезают, но у трети больных возникают спайки. Артрит и артралгии развиваются у 45% больных [11,12], очень редко как единственное проявление болезни. Суставные проявления имеют характер летучих артралгий, моноартрита, реже полиартрита, чаще вовлекаются коленные и голеностопные суставы. По окончании приступа эти явления полностью исчезают, не оставляя пролиферативных изменений. Ревматоид ный фактор, антистрептококковые антитела не определяются. Редко (13%) встречается рожеподобная эритема в виде болезненных плотноватых пятен диаметром 10-15 см обычно в области голеностопных суставов [11,12]. Самым тяжелым осложнением является АА-амилоидоз, строящийся из циркулирующего белка-предшественника S):1–112. AA, близкого С-реактивному белку. Частота амилоидоза значительно отличается по данным разных авторов. О.М. Виноградова на примере популяции бывшего СССР указывает частоту амилоидоза 41,3%. Аме риканские авторы, обследовавшие популяцию армян, проживающих в США, сообщают о низкой частоте амилоидоза – 2% [8,21]. В любом случае, прогноз болезни определяется наличием и тяжестью амилоидоза. Клинические проявления амилоидоза характерны для АА-типа, при котором основным органом-мишенью являются почки. В течении амилоидной нефропатии обычно удается выделить три стадии – протеинурическую, нефротическую и стадию почечной недостаточности. Особенностью амилоидоза является сохранение высокой протеинурии на стадии хронической почечной недостаточности [22]. Нелеченный ААамилоидоз в рамках ПБ обычно прогрессирует быстрее, чем при других воспалительных заболеваниях: 5- и 10летняя выживаемость составляет соответственно 48% и 24%, соответственно, а при вторичном АА-амилоидозе другой этиологии – 77% и 44% [23]. Широко распространено мнение о наследственном характере амилоидоза при ПБ. Так, у больных ПБ с отягощенным по амилоидозу семейным анамнезом риск амилоидоза увеличивается в 6 раз [24]. Описан так называемый фенотип II ПБ (некоторые исследователи ставят под сомнение наличие фенотипа II, учитывая его исключительную редкость [25]), при котором клинически выраженных приступов не бывает, однако развивается АА-амилоидоз. При этом у родственников нередко регистрируется клиника несомненной ПБ. Благодаря обнаружению в последние годы гена ПБ и его продукта – белка пирина показаны различные механизмы наследования ПБ и АА-амилоидоза. Пирин непосредственно не участвует в метаболизме S):1–112. AA, а гены обоих белков располагаются в разных хромосомах (гены S):1–112. AA обнаружены в 11 хромосоме). Таким образом, ПБ в настоящее время, подобно другим хроническим воспалительным процессам, рассматривают в качестве пускового фактора вторичного АА-амилоидоза. У больных ПБ описаны единичные наблюдения асептического менингита, перикардита, миалгий, узелкового полиартериита, гломерулонефрита, пурпуры Шенлейн-Геноха, клиническое значение которых не вполне ясно [4]. Спленомегалия, как правило, сопутствует амилоидозу [4]. Оценка активности аутовоспалительных заболеванийПервая попытка создания критериев активности аутовоспалительных заболеваний была предпринята группой ученых из Клиники Шиба (Израиль) в отношении ПБ [26]. В разработанной ими шкале учитываются возраст на момент начала заболевания, частота приступов, наличие артритов, рожеподобной эритемы и доза колхицина, необходимая для достижения ремиссии болезни. В 2005 г. ученые из той же клиники провели дополнительное исследование, в котором показали недостаточность этой шкалы для корректной оценки активности болезни [27]. С использованием статистических методов были разработаны новые критерии тяжести ПБ (модифицированные критерии Тель Хашомер), которые отличаются для больных, принимающих и не принимающих колхицин [27]. Эксперты рабочих групп EUROFEVER и EUROTRAPS):1–112. попытались разработать единые критерии активности семейных периодических лихорадок с использованием дельфийского метода и метода номинальных групп [28]. Для каждого заболевания были выделены симптомы, которые, по мнению экспертов и опрошенных больных, свидетельствуют о его высокой активности. В опроснике для больных содержатся ежедневные сведения о наличии и выраженности симптомов в баллах. По завершении месяца сумма баллов делится на количество дней в месяце (30 или 31): максимальной активности соответствует 13 баллов для криопиринопатий и 16 баллов для ПБ, HIDS):1–112. и TRAPS):1–112. Традиционными методами подтверждения воспалительной природы заболевания и оценки его активности являются подсчет лейкоцитов крови и измерение показателей острофазового воспаления – СОЭ, уровня С-реактивного белка (СРБ), фибриногена и других. Нередко при аутовоспалительных заболеваниях развивается анемия, как правило, нормохромная нормоцитарная, которая является следствием хронического воспаления (анемия хронических заболеваний). Веду щую роль в ее патогенезе играют провоспалительные цитокины – ФНО-α, ИЛ-1β, ИЛ-6 и интерферон-g [30,31]. Так, ФНО-α снижает эритропоэз за счет непосредственного блокирующего действия на рост эритроидных клеток-предшественниц и активации их апоптоза в костном мозге [32–34]. ИЛ-6 также подавляет костномозговую пролиферацию эритроидных клеток-предшественниц, снижает синтез эритропоэтина, через стимуляцию печеночной продукции гепсидина блокирует макрофагальное депо железа и его абсорбцию энтероцитами [35]. В последнее время исследователи стали уделять внимание новому показателю активности воспаления – отношению нейтрофилы/лимфоциты – ОНЛ (в норме оно равно 0,78-3,53 с медианой 1,65) [36]. Это надежный маркер, который может быть легко определен по результату клинического анализа крови. В настоящее время показана способность этого показателя отражать активность воспаления при ПБ. А. Ahsen и соавт. определяли ОНЛ и концентрацию СРБ у 62 больных ПБ в стадии ремиссии и 41 здорового человека [37]. Как ОНЛ, так и концентрация СРБ у больных с ремиссией ПБ были выше, чем у здоровых людей. Отмечена умеренная корреляция между этими параметрами (r=0,449, p Лечение периодической болезниНесмотря на наследственный характер ПБ в настоящее время существуют эффективные методы ее лечения. С 1970 г. в практику вошел колхицин, который позволил не только предупреждать приступы болезни, но также проводить лечение и профилактику амилоидоза, что существенно улучшило прогноз больных. Механизм противовоспалительного действия колхицина может быть связан с торможением дегрануляции полиморфноядерных лейкоцитов, способностью уменьшать продукцию ИЛ-1, снижать проницаемость сосудистой стенки. Известный цитостатический эффект колхицина в применяемых дозах, по-видимому, незначителен. Ежедневный прием 1-2 мг колхицина позволяет прово дить надежную профилактику приступов ПБ и амилоидоза. Терапевтическая доза при уже развившемся амилоидозе составляет 2 мг/сут. По данным клиники им. Е.М. Тареева колхицин эффективен даже у большинства больных с нефротическим синдромом, однако эффект наступает не сразу, спустя 2-4 года постоянного приема колхицина. Эффективность препарата при амилоидозе почек резко снижается на стадии почечной недостаточности, свидетельствующей о тяжести склеротических изменений. Указанные дозы обычно хорошо переносятся, в том числе при многолетнем приеме. Нередко развивающаяся в начале лечения диарея носит преходящий характер и, как правило, не требует полной отмены препарата. Приблизительно у 15-20% больных колхицин оказывается изначально неэффективным. Представление о ПБ как о внешней инфламмасомопатии позволило рекомендовать назначение ингибиторов ИЛ-1 пациентам, резистентным к лечению колхицином. В Рос сийской Федерации зарегистрирован канакинумаб (Иларис®) – человеческие моноклональные IgG1 антитела к ИЛ-1, которые связываются с цитокином и блокируют его взаимодействие с рецепторами. Канакинумаб обладает длительным периодом полувыведения (21-28 дней), что позволяет вводить его подкожно каждые 8 недель. Рекомендуемая стартовая доза у взрослых составляет 150 мг один раз в 4 недели, при необходимости ее можно увеличить до 300 мг. Эффективность и безопасность канакинумаба изучались у больных с различными аутовоспалитель ными заболеваниями. В двойном слепом, плацебоконтролируемом, рандомизированном исследовании, состоявшем из 3 час тей, 35 пациентов с криопиринассоциированным периодическим синдромом (КАПС; синдром Макла-Уэллса у 33 и синдром NOMID/CINCA у 2) получали канакинумаб в течение 48 недель [52]. Во время части 1 всем пациентам вводили канакинумаб в дозе 150 мг подкожно. Если в течение 15 дней после введения препарата наблюдался полный ответ (отсутствие активности или минимальная активность по оценке исследователя и концентрации СРБ и S):1–112. AA ТАБЛИЦА 1. Эффективность канакинумаба в исследовании CLUSTER Канакинумаб | Плацебо | p | | ||||||||||||||||||||||||||||||||||||||||||
| Частота ответа, n/N (%) | ||||||||||||||||||||||||||||||||||||||||||||||||
| ПБ | 19/31 (61,3) | 2/32 (6,3) |




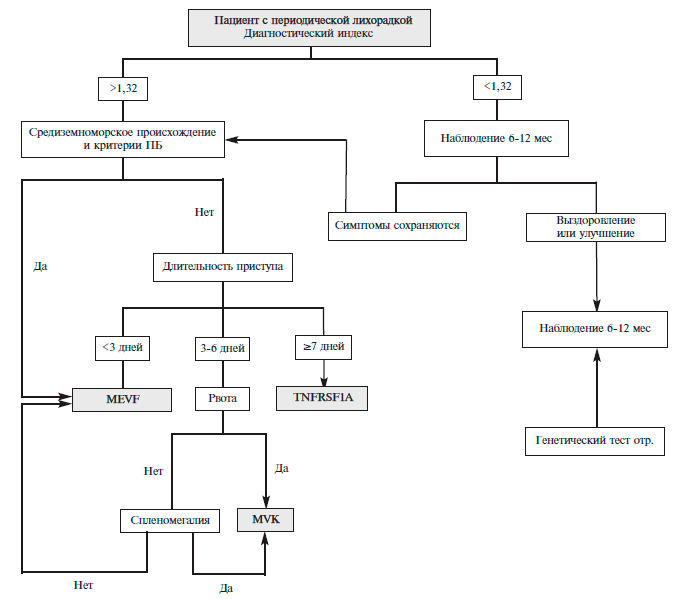 Рис. 1. Алгоритм применения диагностического индекса риска семейных периодических лихорадок
Рис. 1. Алгоритм применения диагностического индекса риска семейных периодических лихорадок