злокачественное образование легкого код по мкб 10
Злокачественное новообразование бронхов и легкого (C34)
[см. примечание 5 в блоке C00-D48]
Алфавитные указатели МКБ-10
Внешние причины травм — термины в этом разделе представляют собой не медицинские диагнозы, а описание обстоятельств, при которых произошло событие (Класс XX. Внешние причины заболеваемости и смертности. Коды рубрик V01-Y98).
Лекарственные средства и химические вещества — таблица лекарственных средств и химических веществ, вызвавших отравление или другие неблагоприятные реакции.
В России Международная классификация болезней 10-го пересмотра (МКБ-10) принята как единый нормативный документ для учета заболеваемости, причин обращений населения в медицинские учреждения всех ведомств, причин смерти.
МКБ-10 внедрена в практику здравоохранения на всей территории РФ в 1999 году приказом Минздрава России от 27.05.97 г. №170
Выход в свет нового пересмотра (МКБ-11) планируется ВОЗ в 2022 году.
Сокращения и условные обозначения в Международой классификации болезней 10-го пересмотра
БДУ — без дополнительных уточнений.
НКДР — не классифицированный(ая)(ое) в других рубриках.
† — код основной болезни. Главный код в системе двойного кодирования, содержит информацию основной генерализованной болезни.
* — факультативный код. Дополнительный код в системе двойного кодирования, содержит информацию о проявлении основной генерализованной болезни в отдельном органе или области тела.
Рак легких
Рак легкого – это злокачественная опухоль, источником которой являются клетки бронхиального и альвеолярного эпителия. Это опасное заболевание характеризуется неконтролируемым ростом клеток в тканях лёгкого, склонностью к метастазированию. При отсутствии лечения опухолевый процесс может распространиться за пределы легкого в близлежащие или отдаленные органы. В зависимости от характеристик опухолеобразующих клеток, основными типами рака легких являются мелкоклеточный рак легкого (МРЛ) и немелкоклеточный рак лёгкого (НМРЛ).
По данным ВОЗ эта болезнь занимает одну из лидирующих позиций неинфекционных заболеваний, ставших причиной смерти до 70 лет.
Классификация
По месту первичного очага классифицируют виды опухоли легкого.
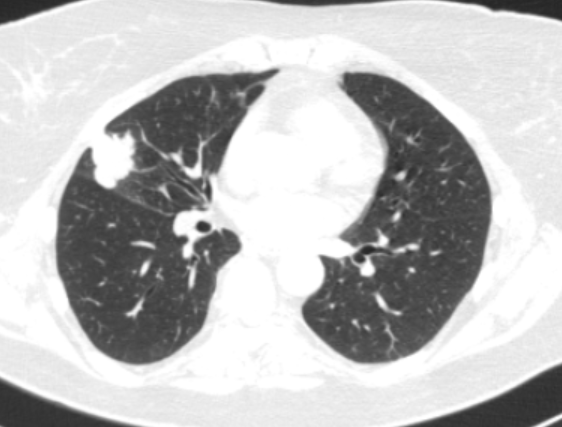
Центральный рак локализирован в проксимальных (центральных) отделах бронхиального дерева. Первые признаки рака легких (симптомы), которые должны насторожить, в этом случае выражены ярко:
Фото 1 — Центральный рак правого нижнедолевого бронха (1) с обтурацией и метастазами (2) в бифуркационные лимфатические узлы
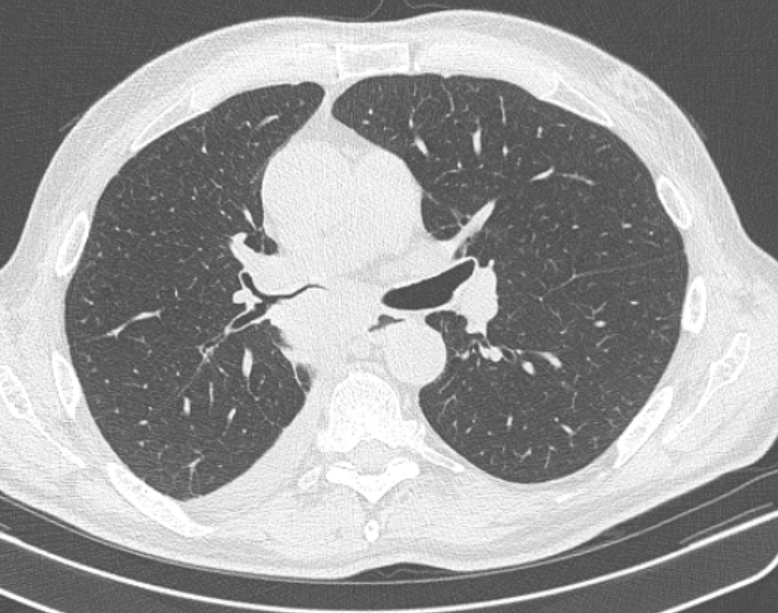
Периферический рак постепенно сформировывается в боковых отделах легких, медленно прорастая и ничем себя не обнаруживая. Данная опухоль легкого симптомы долгое время может не давать, они появляются при значительном местном распространении, вовлечении соседних органов и структур, прорастания бронхов. Диагностика рака легких этого типа локализации чаще всего возможна при профилактическом обследовании (рентгенографии или компьютерной томографии).
Фото 2 — Периферический рак (1) верхней доли правого легкого
Причины
Причиной рака легких, в подавляющем большинстве случаев (до 85%), становится долгосрочное табакокурение. В 10-15-процентной вероятностью заболевание проявляется у людей, которые не имеют этой вредной привычки. В этом случае можно отметить сочетание генетических факторов и воздействие радона, асбеста, вторичного табачного дыма или других форм загрязнения воздуха.
Диагностика
Онкология легких обычно выявляется при рентгенографическом исследовании грудной клетки и компьютерно-томографическом сканировании (КТ). Диагноз подтверждается биопсией, которая обычно выполняется при трахеобронхоскопии или под КТ контролем.
Профилактика
Профилактикой рака легкого является снижение влияния факторов риска:
Лечение
Лечение онкологии легких и отдаленные результаты зависят от типа рака, степени распространения (стадии), а также общего состояния здоровья человека. При немелкоклеточном раке легкого применяют:
Для мелкоклеточного рака легкого характерна лучшая чувствительность к медикаментозной и лучевой терапии.
Хирургический метод лечения рака легкого
— основной радикальный способ при 1-3 стадии болезни. Операции, выполняемые при данном заболевании классифицируются:
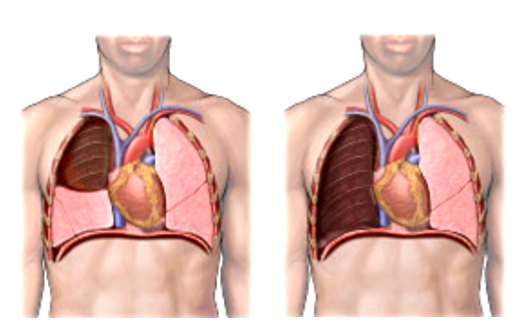
Фото 3 — Лобэктомия
Фото 4 — Пневмонэктомия
При лечении местнораспространенного злокачественного образования с переходом на главный бронх и лёгочную артерию, в тех случаях, где раньше единственным вариантом оперативного лечения являлась пневмонэктомия, сейчас возможно выполнение органосохранных операций. В этом случае иссекается пораженный участок главного бронха с последующим восстановлением непрерывности (бронхопластические и ангиопластические лобэктомии)
Фото 5 — Схема верхней бронхопластической лобэктомии
Лучевая терапия рака лёгкого
На сегодняшний день активное внедрение получают такие современные методы радиотерапии, как IMRT (радиационная терапия с возможностью изменения дозы излучения), 3Д конформная лучевая терапия (трехмерное компьютерное планирование избирательного облучения) стереотаксическая (точно сфокусированная) лучевая терапия. В проведении этих манипуляций, помимо онкологов, участвуют медицинские физики, врачи-радиологи, физики-дозиметристы и др. специалисты.
Химиотерапия
Планирование курса лечения немелкоклеточного рака лёгкого включает в себя использование фармакологических средств. Применяется в целях профилактики: адъювантная (вспомогательная), послеоперационная химиотерапия при 2-3 стадии заболевания и в терапевтическом курсе.
В зависимости от гистологического типа опухоли, стадии заболевания и предполагаемой чувствительности к воздействию, разработаны различные схемы применения химиопрепаратов.
Таргетная терапия (англ. target – мишень, цель)
Отдельный вид фармакологического лечения, заключающийся в назначении препаратов-ингибиторов, действующих только на опухолевые клетки, в которых выделены различные нарушения, задерживающих или даже блокирующих дальнейший рост.
Существуют таргетные препараты, для назначения которых не требуется выявление каких-либо нарушений в опухолевых клетках. К ним относятся бевацизумаб (ингибитор VEGF), ниволюмаб и пембролизумаб (анти PDL1 антитела).
Прогноз жизни
Прогноз онкологии легких при НМРЛ включает симптоматику, размер опухоли (> 3 см), неплоскоклеточный гистологический вариант, степень распространения (стадию), метастазирование в лимфаузлы и сосудистую инвазию. Неоперабельность заболевания, выраженная клиника и потеря веса более, чем на 10% — дают более низкие результаты. Прогностические факторы при мелкоклеточном раке легкого включают в себя статус состояния, пол, стадию заболевания и вовлеченность центральной нервной системы или печени во время диагностики.
Для немелкоклеточного рака легкого прогноз жизни, при полной хирургической резекции стадии IA (ранняя стадия заболевания) — 70% пятилетняя выживаемость.
Диагностика и лечение рака лёгких
В РФ рак лёгкого занимает ведущую позицию в структуре онкологических заболеваний. Мужчины болеют чаще, чем женщины. Заболевание обычно диагностируется на поздней стадии опухолевого процесса. Раннюю диагностику опухолевых заболеваний лёгких проводят в Юсуповской больнице.
Рентгенологи выполняют исследование, используя цифровые аппараты экспертного класса, обладающие высокими разрешающими способностями. Применение инновационных диагностических процедур позволяет установить точный диагноз при наличии малейшего объёмного образования в лёгких. Ранняя терапия новейшими химиотерапевтическими препаратами, современные оперативные методики, применяемые онкологами Юсуповской больницы, позволяют значительно увеличить пятилетнюю выживаемость пациентов, у которых выявлен рак лёгких.
Причины
Рак лёгкого – злокачественная опухоль, которая формируется вследствие неконтролируемого деления эпителиальных клеток слизистой оболочки мелких и крупных бронхов. Известны следующие факторы, повышающие риск развития злокачественной опухоли лёгких:
Канцерогены (курение табака, вдыхание промышленной пыли);
Хроническое воспаление бронхов.
Точной причины рака лёгких не установлено. Заболевание может развиться под воздействием нескольких опухолевых агентов.
В зависимости от локализации опухоли различают следующие виды рака лёгких:
Центральный – формируется в крупных бронхах вплоть до сегментарных отделов;
Периферический – образуется в конечных бронхах, на периферии лёгкого.
Морфологи считают гистологическую классификацию рака лёгкого условной, поскольку течение той или иной опухоли может отличаться от предполагаемой клинической картины. Несмотря на это, онкологи выделяют следующие формы злокачественных новообразований лёгких:
Наиболее распространён такой гистологический вид рака лёгких, как аденокарцинома. Она под микроскопом имеет форму железистых образований с отчётливыми контурами, которые происходят из конечных отделов дыхательной системы. Чаще встречается у женщин. Характеризуется медленным течением, рано даёт множественные метастазы.
Плоскоклеточный рак состоит из видоизменённых эпителиальных клеток трахеобронхиального дерева. Опухоль формируется медленно и поздно даёт метастазы.
Наиболее опасная и злокачественная опухоль – мелкоклеточный рак. Новообразование развивается из патологически измененных клеток плоского эпителия. Онкологи считают, что основная причина этой опухоли – курение табака. При своевременной диагностике мелкоклеточного рака прогноз благоприятный.
Недифференцированный рак состоит из крупных опухолевых клеток, не имеющих чёткой дифференцировки. Прогноз при выявлении этого вида злокачественной опухоли наиболее неблагоприятный.
Мезотелиома плевры встречается довольно редко. Опухоль развивается из плевральных оболочек. Заболевание лечится с помощью оперативного вмешательства.
Симптомы
Клиническая картина рака лёгких зависит от места расположения опухоли, её размеров и наличия метастазов. К онкологам Юсуповской больницы следует обращаться немедленно при появлении следующих симптомов:
Боль в грудной клетке;
Беспричинная потеря массы тела.
У больных раком лёгких возникают вторичные признаки онкологического заболевания: незначительное повышение температуры тела, апатия, вялость, утрата трудоспособности. В 15% случаев рак лёгких протекает бессимптомно. Его выявляют случайно при прохождении пациентом профилактического обследования с помощью флюорографии.
При прогрессировании рака легких и развитии метастазов у больных отмечается появление:
слабости в руках и ногах;
неврологических симптомов (например, головокружений);
пожелтения кожных покровов лица и белков глаз.
В распоряжении клиники онкологии Юсуповской больницы имеется компьютерная техника последнего поколения, новейшие приборы и роботизированные системы от ведущих фирм – производителей медицинской техники, что позволяет выявить даже мельчайшую опухоль.
Диагностика
Диагностика рака лёгких на ранних стадиях заболевания – достаточно сложная задача, поскольку результаты исследований в некоторых случаях отражают не развитие злокачественной опухоли, а других заболеваний (бронхита, пневмонии).
Один из основных методов обнаружения рака лёгких – рентгенологическое исследование. Рентгенографию в Юсуповской больнице проводят с помощью цифровых аппаратов экспертного класса. Для уточнения диагноза рентгенологи используют компьютерную томографию (КТ). Для того чтобы определить стадию опухолевого процесса, проводят позитронно-эмиссионную компьютерную томографию (ПЭТ-КТ). Этот метод исследования особо эффективен в диагностике рака Пенкоста. Его применяют для того, чтобы оценить возможность выполнения радикального оперативного вмешательства.
С помощью бронхоскопии врачи Юсуповской больницы выявляют карциному, выступающую в просвет бронхов, инфильтрацию стенок бронха опухолью или их сдавливание новообразованием. В ходе исследования врач вводит в трахею и бронхи пациента гибкую трубку, оснащённая объективом. Благодаря ему врач имеет возможность произвести визуальный осмотр слизистой оболочки бронхиального дерева. При наличии подозрительного участка он производит биопсию – забор образцов тканей для гистологического исследования. Эндоскопическое бронхологическое обследование при планировании оперативного вмешательства позволяет определить предполагаемый объём и характер резекции лёгкого, возможность проведения реконструктивных бронхопластических операций.
Если, несмотря на проведенные исследования, у онколога остаются сомнения о характере опухоли, пациенту проводят диагностическую торакоскопию или торакотомию со срочной биопсией образцов биологического материала из поражённого участка лёгкого и близлежащих лимфатических узлов.
В диагностически неясных случаях торакальные хирурги проводят резекцию фрагмента легкого, в котором локализуется опухоль, или лобэктомию с выполнением срочного гистологического исследования. При подтверждении злокачественного характера новообразования врачи индивидуально подбирают оптимальный вариант оперативного вмешательства.
Лечение
Онкологи Юсуповской больницы применяют все известные сегодня методы лечения рака лёгких:
При наличии показаний проводят комбинированное лечение. Выбор тактики зависит стадии опухолевого процесса и общего состояния пациента. Оперативные вмешательства выполняют больным немелкоклеточными формами рака. Хирурги клиники онкологии удаляют опухоль с фрагментами лёгкого или проводят удаление лёгкого и регионарных лимфатических узлов. На исход оперативного вмешательства влияют следующие факторы:
Оперативные вмешательства выполняют торакальные онкологические хирурги, которые имеют большой опыт лечения больных раком лёгких.
Лучевая терапия проводится с использованием новейшего оборудования ведущих мировых производителей. Проводится облучение поражённого участка лёгких и путей оттока лимфы, по которым могут метастазировать атипичные клетки.
В ходе химиотерапевтического лечения в организм пациента вводят лекарства, которые избирательно подавляют рост патологических клеток и при этом минимально воздействуют на здоровые ткани и органы пациента. Для химиотерапии врачи Юсуповской больницы используют эффективнейшие лекарственные средства, которые обладают минимальным количеством побочных эффектов.
Для того чтобы пройти обследование при наличии симптомов, позволяющих заподозрить наличие рака лёгких, записывайтесь на приём к онкологу Юсуповской больницы, позвонив по телефону. Специалисты контакт-центра подберут удобное вам время приёма ведущего специалиста в области патологии дыхательной системы. Пациенты клиники онкологии имеют возможность пройти сложные исследования в клиниках-партнёрах Юсуповской больницы.
Рак легкого
Общая информация
Краткое описание
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Гистологическая классификация (ВОЗ, 2004)
| Легкие | PUL |
| Кости | OSS |
| Печень | HEP |
| Головной мозг | BRA |
| Лимфоузлы | LYM |
| Костный мозг | MAR |
| Плевра | PLE |
| Брюшина | PER |
| Надпочечники | ADR |
| Кожа | SKI |
| Другие | OTH |
Диагностика
Дифференциальный диагноз
Лечение
Мелкоклеточный рак
Неоадъювантная химиотерапия до сих пор считается экспериментальным методом лечения. Тем не менее неоадъювантная химиотерапия приводит к снижению клинической стадии у 40-60% пациентов, а к полному патологическому ответу у 5-10% больных. Как выяснилось неоадъювантная химиотерапия лучше переносится, чем адъювантная: три полноценных курса химиотерапии способны перенести более 90% пациентов, в то время как адъювантная химиотерапия назначается только 45-60% больным.
Полагаясь на современные знания, неоадъювантная химиотерапия должна быть представлена, по крайней мере, тремя циклами платиносодержащего режима. Как и при распространенном немелкоклеточном раке легких наиболее предпочтительным режимом химиотерапии является дуплет из цисплатина и препарата третьего поколения. Предоперационная химиотерапия должна рассматриваться у пациентов с IIIA-N2 стадией заболевания.
Все больные немелкоклеточным раком получают дистанционную лучевую терапию (конвекциональную или комформную) на область первичного очага и зоны регионарного метастазирования. Для проведения лучевого лечения обязательно учитывается качество излучения, локализация и размеры полей.
Объем облучения определяется размерами и локализацией опухоли и зоной регионарного метастазирования и включает опухоль + 2 см тканей за пределами ее границ и зону регионарного метастазирования.
Интервал между курсами 21 день.
Платиносодержащие режимы в комбинации с винорельбином, гемцитабином, таксанами, иринотеканом или пеметрекседом при неплоскоклеточном варианте увеличивают продолжительность жизни, улучшают качество жизни и контролируют симптомы у пациентов с удовлетворительным соматическим статусом.
Однако больные, получающие третью, или четвертую линии ХТ, редко достигают объективного улучшения, который обычно бывает очень коротким при значительной токсичности. Для этих больных единственно правильным методом лечения является симптоматическая терапия.
Эрлотиниба гидрохлорид значительно увеличивает выживаемость больных НМРЛ, независимо от физического состояния, пола, возраста, предыдущей потери веса тела, отношения к курению, количества ранее полученных схем и их эффективности, длительности заболевания, ослабленным, и пожилым больным.
В связи с тем, что 80% типичных карциноидов легких экспрессируют рецепторы соматостатина, сцинтиграфия с использованием изотопов к рецепторам соматостатина может быть высоко информативной.
Для выявления первичных очагов и метастазов карциноидов тимуса рекомендуется выполнять КТ или МРТ с внутривенным контрастированием. Сцинтиграфия с использованием изотопов к рецепторам соматостатина является дополнительным методом.
Госпитализация
Показания для госпитализации с указанием типа госпитализации: плановая.
Информация
Источники и литература
Информация
Организационные аспекты внедрения протокола
Критерии оценки для проведения мониторинга и аудита эффективности внедрения протокола:
1. Процент вновь выявленных пациентов со злокачественным новообразованием легких, получающих начальное лечение в течение двух месяцев после начала заболевания = (Количество пациентов, с установленным диагнозом рака легких, получающих начальное лечение в течение двух месяцев после начала заболевания/Все пациенты с впервые установленным диагнозом рака легких) х 100%.
2. Процент онкологических больных, получающих химиотерапию в течение двух месяцев после проведения оперативного лечения = (Количество онкологических больных, получающих химиотерапию в течение двух месяцев после проведения оперативного лечения/Количество всех больных раком легких после проведения оперативного лечения, которым требуется проведение химиотерапии) х 100%.
3. Процент рецидивов рака легких у пациентов в течение двух лет = (Все пациенты с рецидивами рака легких в течение двух лет/Все прооперированные пациенты с диагнозом рака легких) х 100%.
Результаты внешнего рецензирования: положительное решение.
Рак легкого. Клинические рекомендации.
Рак легкого
Оглавление
Ключевые слова
Список сокращений
НМРЛ – немелкоклеточный рак легкого
МРЛ – мелкоклеточный рак легкого
EGFR – рецептор эпидермального фактора роста
ALK- анапластическая крупноклеточная лимфома
КТ – компьютерная томография
1. Краткая информация
1.1 Определение
Рак легкого – собирательное понятие, объединяющее различные по происхождению, гистологической структуре, клиническому течению и результатам лечения злокачественные эпителиальные опухоли. Развиваются они из покровного эпителия слизистой оболочки бронхов, бронхиальных слизистых желёз бронхиол и лёгочных альвеол.
1.2. Клинико-анатомическая классификация
Центральный рак лёгкого возникает в бронхах (главном, промежуточном, долевом, сегментарном и субсегментарном). По направлению роста выделяют экзофитный (эндобронхиальный) рак, когда опухоль растёт в просвет бронха; эндофитный (экзобронхиальный) рак с преимущественным ростом опухоли в толщу лёгочной паренхимы; разветвлённый рак с муфтообразно перибронхиальным ростом опухоли вокруг бронхов, а также смешанный характер роста опухоли с преобладанием того или иного компонента.
Периферический рак лёгкого исходит из эпителия более мелких бронхов или локализующийся в паренхиме лёгкого.
Различают узловую округлую опухоль, пневмониеподобный рак и рак верхушки лёгкого с синдромом Панкоста. [1,2]
1.3 Этиология
У подавляющего большинства больных раком легкого (85-90%) развитие заболевания связано с курением, как активным, так и пассивным. Кроме того, к факторам риска можно отнести облучение (проводимая ранее лучевая терапия по поводу других опухолей внутригрудной локализации), родон, асбест, мышьяк. [3]
1.4 Эпидемиология
По заболеваемости рак легкого занимает 1-е место среди других злокачественных опухолей у мужчин в России, а по смертности — 1-е место среди мужчин и женщин как в России, так и в мире.
В России в 2015 г. раком легкого заболели 55 157 человек. От рака легкого ежегодно умирает больше больных, чем от рака простаты, молочной железы и толстой кишки вместе взятых.
1.5 Кодирование по МКБ 10
Злокачественное новообразование бронхов и легкого (C34)
C34.0 – Злокачественное новообразование главных бронхов, киля трахеи, корня легкого
C34.1 – Злокачественное новообразование верхней доли, бронхов или легкого
C34.2 – Злокачественное новообразование средней доли, бронхов или легкого
C34.3 – Злокачественное новообразование нижней доли, бронхов или легкого
C34.8 – Поражение бронхов или легкого, выходящее за пределы одной и более вышеуказанных локализаций
C34.9 – Злокачественное новообразование бронхов или легкого неуточненной локализации
1.6 Классификация
Международная гистологическая классификация (2015) [22]:
1. Преинвазивные образования:
2. Аденокарцинома
Со стелющимся типом роста (lepedic) G1
Микропапиллярная G III
Инвазивная муцинозная аденокарцинома
Смешанная инвазивная муцинозная и немуцинозная аденокарцинома
3. Плоскоклеточный рак
4. Нейроэндокринные опухоли
— Комбинированный мелкоклеточноый рак
— Крупноклеточная нейроэндокринная карцинома
— Комбинированная крупноклеточная нейроэндокринная карцинома
5. Крупноклеточная карцинома
6. Другие неклассифицируемые опухоли:
Опухоли по типу опухолей слюнных желез:
1.7 Стадирование
Стадирование рака легкого по системе TNM (7-я редакция 2009, табл. 1)[4]
Символ Т (первичная опухоль) содержит следующие градации:
Символ N указывает на наличие или отсутствие метастазов в регионарных лимфатических узлах
Символ М характеризует наличие или отсутствие отдаленных метастазов
Mlb — отдаленные метастазы. Для уточнения локализации отдаленного метастатического очага (М) применяют дополнительную градацию:
OSS – кости SKI – кожа
ADP – почки SADP- надпочечники
HEP – печень OTH – другие
При клинической оценке распространенности опухолевого процесса перед символами TNM ставиться критерий «с», а при патогистологической классификации – критерий «р». Требования к определению категории pT,pN,pM аналогичны таковым при категории сT,сN,сM. Символ рN может быть оценен при исследовании не менее шести лимфатических узлов, три из которых средостенные, из них один – бифуркационный.
Таблица 1 – Стадии рака легкого
Стадия
2. Диагностика
2.1 Жалобы и анамнез
Выраженность клинической симптоматики при раке легкого зависит от клинико-анатомической формы новообразования, его гистологической структуры, локализации, размеров и типа роста опухоли, характера метастазирования, сопутствующих воспалительных изменений в бронхах и легочной ткани.
· Кашель при центральном раке легкого у большинства больных сухой, временами надсадный. С нарастанием обтурации бронха кашель может сопровождаться мокротой слизистого или слизисто-гнойного характера.
· Кровохарканье может проявляться в виде прожилок алой крови в мокроте или в виде диффузно окрашенной.
· Одышка выражена тем ярче, чем крупнее просвет поражённого бронха при центральном раке или зависит от размера периферической опухоли, т.е. степени сдавления анатомических структур средостения, особенно крупных венозных стволов, бронхов и трахеи.
· Боль в грудной клетке различной интенсивности на стороне поражения может быть обусловлена локализацией новообразования в плащевой зоне лёгкого, особенно при прорастании плевры и грудной стенки, а также наличием плеврального выпота или ателектаза лёгкого с признаками обтурационного пневмонита.
Перечисленные симптомы и синдромы не патогномоничны для рака лёгкого и могут иметь место при неопухолевой лёгочной и общесоматической внелёгочной патологии. Так, например, кровохарканье может наблюдаться при туберкулёзе лёгкого и декомпенсированной кардиальной патологии; одышка — при хронических обструктивных заболеваниях лёгких; боли в грудной клетке — при воспалительных плевритах, радикулитах, межрёберной невралгии; кашель — при простудных, вирусных инфекциях, туберкулёзе и гнойных процессах в лёгких; симптомы общей интоксикации присущи большой группе заболеваний.
У некоторых пациентов можно выявить паранеопластические синдромы, связанные с гиперпродукцией гормонов (синдром секреции адренокортикотропного, антидиуретического, паратиреоидного гормонов, эстрогенов, серотонина). Рак лёгкого может сопровождаться тромбофлебитом, различными вариантами нейро- и миопатии, своеобразными дерматозами, нарушениями жирового и липидного обмена, артралгическими и ревматоидноподобными состояниями. Нередко проявляется остеоартропатией (синдром Мари–Бамбергера), заключающейся в утолщении и склерозе длинных трубчатых костей голеней и предплечий, мелких трубчатых костей кистей и стоп, припухлости суставов (локтевых, голеностопных), колбовидном утолщении концевых фаланг пальцев кистей («барабанные палочки»). При периферическом раке верхушки лёгкого возможно появление синдрома Бернара–Горнера (птоз, миоз, энофтальм) в сочетании с болями в плечевом суставе и плече, прогрессирующей атрофией мышц дистальных отделов предплечья, обусловленными непосредственным распространением опухоли через купол плевры на плечевое сплетение, поперечные отростки и дужки нижних шейных позвонков, а также симпатические нервы.
2.2 Физикальное обследование
2.3 Лабораторная диагностика
Определение опухолевых маркеров
Опухолевые маркеры могут помочь в дифференциальной диагностике и оценке эффективности проводимого лечения. При раке легкого, в зависимости от его гистологической структуры, возможно определение следующих маркеров: нейронспецифическая энолаза (НСЕ) и раково-эмбриональный антиген (РЭА) при мелкоклеточном; цитокератиновый фрагмент (CYFRA 21-1), маркер плоскоклеточного рака (SCC), РЭА при плоскоклеточном; РЭА, CYFRA 21-1, СА-125 при аденокарциноме; CYFRA 21-1, SCC, РЭА при крупноклеточном раке.
2.4 Инструментальная диагностика
Рентгенологическая диагностика
Решающее значение в рентгенологической диагностике центрального рака лёгкого имеют проявления стеноза бронха (сегментарного или долевого): экспираторная эмфизема, гиповентиляция, ателектаз, отчётливо видимые на обзорных рентгенограммах в прямой и боковой проекциях. Эти симптомы раньше обнаруживают при эндобронхиальном росте опухоли. При экзобронхиальном росте опухоль увеличивается вначале экспансивно в форме узла и лишь по достижении им определённых размеров, при сдавлении или прорастании бронха рентгенологически проявляются нарушения бронхиальной проходимости. Томография, особенно в специальных проекциях, позволяет получить исчерпывающую информацию о состоянии бронхиального дерева (стеноз, окклюзия, протяжённость поражения), характере и степени распространения опухоли на лёгочную ткань, окружающие органы и структуры (средостение, плевра, грудная стенка, диафрагма, внутригрудные лимфатические узлы).
Рентгенологическую диагностику периферического рака лёгкого у абсолютного большинства больных начинают с анализа патологических изменений, ранее обнаруженных на флюорограммах. Распространённое мнение о преимущественно шаровидной форме периферического рака лёгкого относится к опухолям, диаметр которых превышает 3–4 см. Опухоль диаметром до 2 см чаще представляет собой полигональную тень в лёгочной паренхиме с неодинаковыми по протяжённости сторонами и напоминает звёздчатый рубец. Относительно редко опухоль с самого начала имеет овальную или округлую форму. Характерна нечёткость, как бы размытость контуров тени. Опухолевая инфильтрация окружающей лёгочной ткани приводит к образованию вокруг узла своеобразной лучистости (corona maligna). Полицикличность и лучистость контуров более характерны для недифференцированных форм рака, что, вероятно, обусловливает их быстрый рост и высокие инвазивные свойства.
Компьютерная томография органов грудной клетки
Метод КТ является основным в первичной диагностике местной распространенности опухолевого процесса в грудной клетке, при динамическом наблюдении после хирургического, лучевого и химиотерапевтического лечения. Это обусловлено высокой разрешающей способностью метода, позволяющего на ранних этапах выявить семиотические признаки злокачественности. Современные возможности КТ позволяют не только диагностировать центральный рак до появления симптомов нарушения вентиляции легочной ткани, но выявлять начальные его формы, включая перибронхиально (разветвленная, узловая) растущие опухоли. Информативность КТ в первичной диагностике центрального рака легкого сопоставима с таковой при фибробронхоскопии, превышая последнюю при перибронхиальном росте опухоли. Применение методики внутривенного болюсного контрастного исследования позволяет улучшить результативность КТ диагностики. Наиболее характерной КТ–картиной периферического рака легкого до 3 см в диаметре при стандартной методике исследования являются: образование шаровидной или овоидной форы со спикулообразными либо мелкобугристыми контурами, преимушественно однородной структуры. Симптом «лимфогенной дорожки» к корню или плевре, чаще характерный для рака легкого, определяется не во всех наблюдениях. Реакция висцеральной плевры над периферическим узлом – «пупковидное втяжение плевры», являющийся относительным симптомом первичного рака легкого, выявляется только у трети больных. По мере увеличения размеров опухоли (свыше 3 см) чаще выявляют неправильно округлую или многоузловую форму новообразования, появляются крупнобугристые очертания и неоднородность структуры за счет участков некроза или распада.
Фибробронхоскопия
Бронхологическое исследование относят к основным и обязательным методам диагностики рака легкого. Оно позволяет не только визуально исследовать гортань, трахею и все бронхи, непосредственно увидеть локализацию опухоли, определить границы ее распространения, косвенно судить об увеличении лимфатических узлов корня легкого и средостения, но и произвести биопсию для гистологического исследования, получить материал (браш-биопсия, мазки-отпечатки, соскоб или смыв из бронхиального дерева) для цитологического изучения, т.е. морфологически подтвердить диагноз и уточнить гистологическую структуру опухоли. В последние годы все шире используются диагностические аппараты, заключающие в себя возможности рентгеноэндоскопии, эндосонографии и флюоресцентной эндоскопии. Наиболее перспективным методом выявления скрытых микроочагов рака слизистой оболочки считается флюоресцентная эндоскопия, основанная на эффекте аутофлюоресценции и регистрации концентрации в опухоли эндогенных фотосенсибилизаторов. [1,2]
Диагностическая видеоторакоскопия и торакотомия
Диагностические операции в большей степени показаны пациентам с периферическим шаровидным образованием в легком, когда совокупность результатов перечисленных ранее методов диагностики не позволяет верифицировать процесс, а вероятность злокачественной опухоли остается высокой. После интраоперационной ревизии и срочной морфологической диагностики в зависимости от клинической ситуации операцию завершают адекватным объемом удаления легочной ткани, а при злокачественном процессе дополняют медиастинальной лимфаденэктомией. Показания к диагностической видеоторакоскопии: экссудативный плеврит неясной этиологии; первичные опухоли плевры; необходимость определения стадии рака легкого; метастазы опухоли в легком и по плевре; диссеминированные заболевания легких; злокачественные опухоли средостения; лимфаденопатия средостения.
2.5 Иная диагностика
Следует стремиться к уточнению морфологической формы рака легкого – аденокарцинома/плоскоклеточный, в том числе, с использованием иммуногистохимического исследования.
Уровень убедительности рекомендаций A (уровень достоверности доказательств – Ia)
Уровень убедительности рекомендаций C (уровень достоверности доказательств – IV)
3. Лечение
3.1 Лечение больных немелкоклеточным раком легкого
.1.1. Хирургическое лечение
Основным методом лечения рака легкого является хирургический. Объем операции определяется распространенностью опухолевого процесса, функциональным состояние пациента. Радикальную операцию удается выполнить только у 10–20% всех заболевших. 5-летняя выживаемость при всех формах рака легкого составляет 20–25%.
Хирургическое лечение больных раком легкого подразумевает удаление органа (пневмонэктомия) или его анатомическую (билобэктомия, лобэктомия, сегментэктомия) и неанатомическую (сублобарную) резекцию с очагом болезни, внутрилегочными, корневыми и средостенными лимфатическими узлами.
Медиастинальная лимфодиссекция (удаление клетчатки с лимфатическими узлами регионарных зон метастазирования) является обязательным этапом операции независимо от объема удаляемой легочной ткани [А]. Смыслом медиастинальной лимфодиссекции является превентивное удаление клетчатки и лимфоузлов средостения. Операция должна выполняться острым путем.
Стандартным объемом операции на лимфатических путях средостения следует считать систематическую медиастинальную ипсилатеральную лимфодиссекцию выполняемую вне зависимости от объема удаления легочной паренхимы и величины лимфатических лимфоузлов.
Операция слева подразумевает удаление парааортальных, субаортальных, левых нижних паратрахеальных лимфоузлов, обнажение верхней полуокружности аорты и удалением клетчатки по ходу начальных отделов общей сонной и подключичной артерий. Обязательна перевязка (пересечение) Баталовой связки, что позволяет удалить претрахеальные лимфоузлы, выполнить частичную ревизию правой паратрахеальной области. В объем этой операции входит широкое рассечение медиастинальной плевры и удаление клетчатки переднего средостении с визуализацией на протяжении левой брахиоцефалической вены.
Независимо от стороны операции удаляются бифуркационные, параэзофагеальные и лимфоузлы легочной связки соответствующих сторон.
Расширенная медиастинальная лимфодиссекция (систематическая), т.е. увеличение объема больше описанного (стандартного), подразумевает использование трансстернального доступа с удалением паратрахеальной клетчатки справа и слева, в том числе – выше слияния правой и левой брахиоцефалических вен и надключичных областей. Такая операция не может быть рекомендована к широкому применению в практике и целесообразность ее использования требует специального обсуждения [А, I].
По характеру выполнения операции подразделяют на радикальные и паллиативные. Под радикальной операцией (R0) подразумевают онкологически обоснованное удаление пораженного органа или его резекцию в пределах здоровых тканей с клетчаткой и лимфатическими узлами зон регионарного метастазирования, включая средостенные. Радикальность вмешательства обязательно подтверждают результатами срочного (интраоперационного) и планового морфологического исследований тканей по краю резекции.
Операцию считают паллиативной при микроскопическом (R1) выявлении опухолевых клеток по линии резекции бронха, сосудов, легочной ткани, дополнительно резецированных структур и органов, а также визуально (R2) определяемой опухоли в оставшейся части легкого, на органах и структурах средостения, плевре, при опухолевом плеврите или перикардите, неполном удалении метастатических внутригрудных лимфатических узлов. [1, 2, 7-12].
В последние годы широкое применение при клинической I стадии болезни получили анатомические резекции легкого с медиастинальной лимфодиссекцией из малоинвазивных хирургических доступов. Непосредственные результаты таких вмешательств, превосходят таковые после операций из торакотомии, а онкологические результаты не уступают вмешательствам из открытых доступов [7, 9, 11, 12 ].
Рекомендации по объему хирургического лечения
Хирургическое лечение при раке легкого I клинической стадии.
При раке легкого I клинической стадии, показано хирургическое вмешательство (А).
Стандартный объём операции аналогичен более распространенным формам и включает анатомическую резекцию легкого (лобэктомия, билобэктомия) с ипсилатеральной медиастинальной лимфодиссекцией.
Торакоскопическая лобэктомия и билобэктомия с медиастинальной лимфодиссекцией при I стадии рака легкого обеспечивает лучшие непосредственные результаты и не ухудшает прогноз (IA). Торакоскопические операции при клинической I стадии рака легкого могут быть рекомендованы как стандартный вариант хирургического лечения наряду с обычными открытыми вмешательствами (А).
Рекомендации к применению хирургического лечения как самостоятельного метода или компонента комбинированного и комплексного.
3.1.2. Лучевая терапия
Лучевую терапию применяют как самостоятельное лечение, а также в сочетании с хирургическим или химиотерапевтическим методом. Радикальную лучевую терапию проводят больным I-II стадиями НМРЛ при функциональной неоперабельности, высоком риске хирургических осложнений и отказе пациента [В]. Адъювантную лучевую терапию больным НМРЛ 0-IIB (N0) стадии после радикальных операций не применяют [A].
При II стадии заболевания в случае невозможности проведения хирургического лечения проводится химиолучевая терапия, или лучевая терапия, или химиотерапия. Дистанционная лучевая терапия
Первичная опухоль
Конформная лучевая терапия РОД 2 Гр, СОД 60 Гр (КТ, ПЭТ)
Регионарные лимфатические узлы
Конформная лучевая терапия РОД 2Гр, СОД 40-45Гр (КТ, ПЭТ)
3.1.3 Лекарственное противоопухолевое лечение больных НМРЛ
Адъювантная терапия
После радикальных операций, начиная с IB стадии НМРЛ, показано проведение адъювантной химиотерапии (ХТ), которая улучшает безрецидивную и общую 5-летнюю выживаемость 16. Адъювантную ХТ начинают не позднее 8 недель после операции при восстановлении пациента (ECOG 0–1). Могут быть использованы любые платиносодержащие комбинации с включением химиопрепаратов III поколения или этопозида, всего проводится 4 цикла лечения (таблица 2). Наиболее изученными и часто применяемыми комбинациями являются сочетания винорелбина и цисплатина, гемцитабина и цисплатина, паклитаксела и карбоплатина. При неплоскоклеточном НМРЛ оправдано применение режима пеметрексед + цисплатин. При противопоказаниях к назначению цисплатина можно использовать карбоплатин.
Таблица 2. Режимы адъювантной и неоадъювантной химиотерапии НМРЛ
Винорелбин 25-30 мг/м 2 в/в (или 60-80 мг/м 2 внутрь) в 1-й и 8-й день + цисплатин 75 в/в в 1-й день 21-дневного цикла; до 4 циклов.
Этопозид 100 мг/м 2 в/в в 1-й, 2-й и 3-й день + цисплатин 75 мг/м 2 в/в в 1-й день 28-дневного цикла; до 4 циклов.
Паклитаксел 175-200 мг/м 2 в/в в 1-й день + карбоплатин AUC 5–6 в/в в 1-й день 21-дневного цикла, до 4 циклов.
Доцетаксел 75 мг/м 2 в/в в 1-й день + цисплатин 75 мг/м 2 в/в в 1-й день 21-дневного цикла; до 4 циклов.
Гемцитабин 1000 мг/м 2 в/в в 1-й и 8-й день + цисплатин 75 мг/м 2 в/в в 1-й день 21-дневного цикла; до 4 циклов.
Пеметрексед 500 мг/м 2 в/в в 1-й и 8-й день 21-дневного цикла + цисплатин 75 мг/м 2 в/в в 1-й день; до 4 циклов с премедикацией фолиевой кислотой и витамином В12 за 5–7 дней до начала каждого цикла (только неплоскоклеточный НМРЛ)
Таргетная терапия в адъювантном режиме не проводится.
Послеоперационная лучевая терапия у больных с R0 резекцией не проводится.
В случае невозможности проведения/отказа от хирургического лечения и/или лучевой терапии паллиативную химиотерапию применяют как самостоятельный вариант лечения (см. Лекарственное лечение больных с IV стадией).
IA; IB стадия
Адъювантная ХТ не проводится.
Наблюдение или адъювантная ХТ для больных высокого риска: опухоли > 4 cм, вовлечение висцеральной плевры, сосудистая инвазия, низкая дифференцировка, атипичная резекция, Nх моложе 75 лет.
II–IIIА стадии
При II стадии заболевания в случае невозможности проведения хирургического лечения проводится химиолучевая терапия, или лучевая терапия, или химиотерапия.
Неоадъювантная химиотерапия (2 курса) может рассматриваться у пациентов с IIIA – N2 (доказанный морфологически или при ПЭТ/КТ) стадией болезни в качестве этапа комбинированного лечения [17]. Операцию необходимо выполнять не позднее 3-4 недель от последнего введения химиопрепаратов.
Адъювантная химиотерапия назначается во всех случаях N+ при отсутствии противопоказаний. Следует учитывать ослабленное состояние больных после операции.
IIIА, IIIB стадии (неоперабельные)
Химиолучевая терапия является стандартным подходом при лечении больных НМРЛ с местнораспространенной, неоперабельной III стадией.
Одновременная химиолучевая терапия дает лучшие результаты по сравнению с последовательной, однако она более токсична и проводится больным с ECOG 0-1 [18]. Уровень достоверности доказательств – I
При исходно нерезектабельной опухоли на первом этапе проводится одновременная химиолучевая терапия больным с ECOG 0–1. При ECOG 2 предпочтительнее последовательное использование двух методов с последующими 3–4 консолидирующими курсами химиотерапии.
Планируемая суммарная очаговая доза должна быть не менее 60 Гр. Дистанционная лучевая терапия
Первичная опухоль
Конформная лучевая терапия РОД 2 Гр, СОД 60Гр (КТ, ПЭТ)
Регионарные лимфатические узлы
Конформная лучевая терапия РОД 2Гр, СОД 40-45Гр (КТ, ПЭТ)
Оптимальный объем химиотерапии в составе химиолучевой терапии – еженедельное введение паклитаксела и цисплатина/карбоплатина. При невозможности использовать эти комбинации возможно применение комбинации этопозида и цисплатина/карбоплатина в еженедельном режиме. Возможно применение стандартной химиотерапии (паклитаксел + карбоплатин 1 раз в 3 недели, пеметрексед + цисплатин 1 раз в 3 недели) одновременно с лучевой терапией.
Таблица 3. Режимы, часто применяемые в лечении IIIА, IIIB стадии НМРЛ в комбинации с лучевой терапией.
Паклитаксел 50 мг/м 2 в 1-й, 8-й, 15-й дни в/в + карбоплатин AUC-2 в 1-й, 8-й, 15-й дни в/в
Паклитаксел 50 мг/м 2 в 1-й, 8-й, 15-й дни в/в + цисплатин 25 мг/м 2 в 1-й, 8-й, 15-й дни в/в
Этопозид 100 мг/м 2 в 1-й, 8-й, 15-й дни в/в + карбоплатин AUC-2 в 1-й, 8-й, 15-й дни в/в
Этопозид 100 мг/м 2 в 1-й, 8-й, 15-й дни в/в + цисплатин 25 мг/м 2 в 1-й, 8-й, 15-й дни в/в
При противопоказаниях к химиолучевому лечению проводится системная химиотерапия по принятым схемам (см. Химиотерапия первой линии при IV стадии), либо лучевая терапия.
IV стадия
Лечение назначается с учетом предиктивных и прогностических факторов.
Гистологический вариант опухоли и молекулярно-генетические характеристики являются важными факторами выбора варианта лечения. При выявлении активирующих мутаций гена EGFR (19 и 21 экзоны) или транслокаций ALK, ROS1 оптимальным является назначение таргетной терапии [19]. уровень достоверности доказательств – I (см. Молекулярно-направленная терапия НМРЛ EGFR +, ALK/ROS1+). При отсутствии драйверных молекулярно-генетических нарушений проводится ХТ (см. Химиотерапия первой линии при IV стадии).
Раннее начало поддерживающей и сопроводительной симптоматической терапии увеличивает продолжительность жизни.
Молекулярно-направленная терапия НМРЛ EGFR +, ALK/ROS1+ при IV стадии.
Химиотерапия первой линии при IV стадии
Таблица 4. Активные режимы химиотерапии НМРЛ IV стадии.
Этопозид 120 мг/м 2 в 1, 2, 3-й день в/в + цисплатин 80 мг/м 2 в 1-й день в/в каждые 3 недели.
Этопозид 100 мг/м 2 в 1-й – 3-й день в/в + карбоплатин AUC-5 в 1-й день в/в каждые 3 недели.
Винорелбин 25-30 мг/м 2 в/в (или 60-80 мг/м 2 внутрь) в 1-й и 8-й день + цисплатин 80 мг/м 2 в 1-й день в/в каждые 3 недели.
Паклитаксел 175-200 мг/м 2 в 1-й день + цисплатин 80 мг/м 2 в 1-й день каждые 3 недели.
Паклитаксел 175 – 200 мг/м 2 в 1-й день + карбоплатин AUC 5–6 в 1-й день каждые 3 недели. +/- Бевацизумаб 7,5 мг/кг 1 раз в 3 недели до прогрессирования.
Гемцитабин 1000 мг/м 2 в 1-й и 8-й дни + карбоплатин AUC5 в 1-й день каждые 3 недели.
Пеметрексед 500 мг/м 2 в 1-й день + цисплатин 75 мг/м 2 в 1-й день каждые 3 недели с премедикацией фолиевой кислотой и витамином В12 за 5–7 дней до начала курса
+/- Бевацизумаб 7,5 мг/кг 1 раз в 3 недели до прогрессирования.
Винорелбин 25-30 мг/м 2 в/в (или 60-80 мг/м 2 внутрь ) 1-й, 8-й, 15-й день каждые 4 недели
Этопозид 120 мг/м 2 в/в в 1, 2, 3-й день каждые 3 недели.
Гемцитабин 1000-1250 мг/м 2 в 1-й и 8-й день каждые 3 недели.
Доцетаксел 75 мг/м 2 в/в в 1-й день каждые 3 недели.
Пеметрексед 500 мг/м 2 в 1-й день каждые 3 недели с премедикацией фолиевой кислотой и витамином В12 за 5–7 дней до начала курса
Пембролизумаб 2мг/кг в/в кап каждые 3 недели
Ниволюмаб 3 мг/кг в/в кап каждые 2 недели
Поддерживающая терапия (оптимально)
У пациентов с достигнутой на фоне лечения стабилизацией или регрессией заболевания может быть продолжена поддерживающая терапия после 4–6 циклов ХТ первой линии с учетом токсичности и эффективности. В качестве продолженной поддерживающей терапии возможно применение пеметрекседа (категория 1), бевацизумаба (категория 1) [31] или их комбинации (все опции – при неплоскоклеточном НМРЛ) или гемцитабина (категория 2В) при плоскоклеточном морфологическом подтипе [32], если эти препараты входили в схему лечения.
Химиотерапия второй линии
Метастазы в головной мозг
При несимптомном метастатическом поражении вещества мозга лечение может быть начато с применения системной химиотерапии.
Симптомные метастазы в головной мозг могут быть показанием к нейрохирургическому лечению на первом этапе с последующей химиолучевой терапией. Высокие дозы глюкокортикоидов (дексаметазон до 24 мг/сутки) – обязательный компонент симптоматического лечения, направленного на уменьшение проявлений отека вещества мозга; при неэффективности глюкокортикоидов в рекомендованной дозе дальнейшее повышение дозы нецелесообразно, и свидетельствует о неблагоприятном прогнозе.
Развитие метастазов в головном мозге на фоне эффективной таргетной терапии (гефитиниб, эрлотиниб, афатиниб, кризотиниб) – проявление особенности фармакокинетики препаратов – плохой проницаемости через гематоэнцефалический барьер; в таком случае целесообразно проведение лучевой терапии на головной мозг и продолжение таргетного лечения.
Симптоматическая терапия
Паллиативная лучевая терапия используется на любых этапах заболевания для локального контроля солитарных метастазов, для симптоматического лечения (болевой синдром, кровохаркание, обструкция).
При экссудативном плеврите, сопровождаемом нарастающей одышкой, показано проведение плевроцентеза
При массивном распаде опухоли, вторичной пневмонии рассмотреть вопрос о возможности паллиативной операции.
Адекватное медикаментозное обезболивание
Комментарии: целью так называемой «наилучшей поддерживающей терапии» (best supportive care) является профилактика и облегчение симптомов заболевания и поддержание качества жизни пациентов и их близких, независимо от стадии заболевания и потребности в других видах терапии.
3.2 Лечение больных мелкоклеточным раком легкого
Оперативное лечение МРЛ (лобэктомия) показано лишь при I cтадии (IА и IВ) и в отдельных случаях при II cтадии с обязательной адъювантной химиотерапией по схеме ЕР (или ЕС), 4 курса с интервалом в 3-4 недели [41]. Также показано профилактическое облучение мозга в СД – 25 Гр (по 2,5 Гр х 10 фракций).
При локализованной стадии МРЛ (не выходящий за пределы одной половины грудной клетки) стандартом лечения является химиолучевая терапия. Существуют два варианта химиолучевой терапии: 1 вариант – одновременное применение ХТ и ЛТ, когда лечение начинается с ХТ по схеме ЕР, а ЛТ на область опухоли и средостения присоединяется не позднее второго курса ХТ («ранняя» ЛТ) или после третьего цикла («поздняя» ЛТ). Отмечено недостоверное преимущество «ранней» ЛТ над «поздней»[42]. Второй вариант –последовательное применение ХТ и ЛТ, когда проводятся 2-4 курса ХТ, а после их окончания начинается ЛТ.
При распространенной стадии МРЛ стандартом лечения является ХТ по схеме ЕР или ЕС (этопозид + цисплатин или этопозид + карбоплатин), а также может быть использована схема IP (иринотекан + цисплатин или карбоплатин)[43]. Обычно проводится 4-6 циклов ХТ 1-ой линии с интервалами 3 недели между циклами. В случае необходимости оказания «срочной» помощи больному с выраженным синдромом сдавления ВПВ, возможно применение схемы CAV в 1-ой линии лечения. При достижении ОЭ – показано проведение консолидирующего курса ЛТ на область первичной опухоли и л/у средостения (РОД 2Гр, СОД 50Гр) (уровень достоверности Ib) после завершения ХТ любой схемы[44].
Профилактическое облучение мозга (ПОМ), в виду высокого риска появления метастазов в мозге (до 70%), показано больным после оперативного лечения, после достижения полной или частичной ремиссии при любой стадии МРЛ (уровень достоверности Ib) после завершения основного лечения [45,46]. Суммарная доза ПОМ – 25 Гр (10 сеансов по 2,5 Гр в день). ПОМ увеличивает продолжительность жизни больных МРЛ.
Таблица 5. Рекомендуемые режимы химиотерапии при МРЛ