мдс код по мкб 10
Рефрактерная анемия неуточненная
Рубрика МКБ-10: D46.4
Содержание
Определение и общие сведения [ править ]
В 1982 г. ФАБ-группой была предложена классификация МДС, предусматривающая пять вариантов заболевания:
— рефрактерная анемия с кольцевидными сидеробластами;
— рефрактерная анемия с избытком бластов;
— рефрактерная анемия с избытком бластов в стадии трансформации в острый лейкоз;
— хронический миеломоноцитарный лейкоз.
МДС впервые были введены в классификацию ВОЗ в 2001 г. По сравнению с ФАБ-классификацией, в ней изменилось разделение МДС на варианты и уменьшено допустимое число бластов в периферической крови (менее 5%) и костном мозге (до 20%). В новой схеме не отражен хронический миеломоноцитарный лейкоз, сочетающий в себе морфологические особенности МДС и миелопролифератив-ного заболевания, хотя ряд исследователей вместо него выделяют форму МДС/ МПЗ.
Согласно модифицированной схеме ВОЗ различают следующие варианты первичных МДС:
Первичными МДС, в отличие от вторичных, называют заболевания, причина которых после тщательного обследования больного не была установлена. Вторичные МДС и так называемые вторичные лейкозы, развивающиеся после химио- и лучевой терапии по поводу опухолей различной природы, составляют 10-15% первичных МДС и не входят в приведенную классификацию.
Этиология и патогенез [ править ]
Этиология МДС до конца не изучена; его возникновение многие исследователи связывают с неблагоприятными экологическими факторами, повышенной радиацией, воздействием ряда химических веществ и пр.
Клинические проявления [ править ]
Рефрактерная анемия неуточненная: Диагностика [ править ]
Данные исследований трепанобиопсий при МДС требуют тщательного сопоставления их с результатами лабораторных анализов. Диагноз «МДС» верен при различной, чаще повышенной клеточности кроветворной ткани, наличии диспла-стических изменений в клетках двух или трех линий гемопоэза, так называемых воспалительных участков огрубения в строме (лимфоидная или лимфоплазмоклеточная очаговая пролиферация). Нарушения обмена железа обнаруживают при сидероахрестической форме МДС. Подтверждение любого варианта МДС требует исследования трепанобиоптата костного мозга в динамике, особенно в случаях изменений в клетках гранулоцитарной линии, а также после проведенного лечения, которое может включать и трансплантацию костного мозга или стволовых клеток.
Дифференциальный диагноз [ править ]
Рефрактерная анемия неуточненная: Лечение [ править ]
В настоящее время нет данных, что циторедуктивная терапия полезна для пациентов с РАКС-Т (рефрактерная анемия с кольцевыми сидеробластами, ассоциированная с выраженным тромбоцитозом); более того, назначение гидроксикарбамида может приводить к нарастанию анемии. Показана эффективность леналидомида у единичных пациентов с JAK2V617F с достижением независимости от трансфузий и полной молекулярной ремиссии. Необходимы новые клинические исследования пациентов с РАКС-Т.
Миелодиспластический синдром
Миелодиспластическим синдромом называют группу гетерогенных клональных заболеваний крови, объединенных следующими признаками: неэффективный гемопоэз, периферическая цитопения, дисплазия в одном или более ростке кроветворения с высоким потенциалом трансформации в острый миелоидный лейкоз.
Недостаточное кроветворение проявляется анемией, повышенной кровоточивостью и подверженностью инфекциям. Миелодиспластический синдром (МДС) встречается у людей любого возраста, в том числе и детского, но в большей степени ему подвержены люди после 60 лет.
По МКБ-10 миелодиспластическим синдромам присваивается код D46.
Причины
Клетки крови синтезируются и созревают главным образом в костном мозге (этот процесс называется миелопоэзом, а ткань, в которой он происходит, называется миелоидной), затем, выполнив свою функцию и состарившись, уничтожаются селезенкой, а на их место приходят новые. При миелодиспластическом синдроме костный мозг теряет способность к воспроизводству клеток крови (всех – эритроцитов, лейкоцитов, тромбоцитов или только некоторых) в необходимом организму количестве, в кровь попадают незрелые клетки (бласты), в результате чего она хуже выполняет свои функции. Это проявляется характерной для МДС симптоматикой. Примерно в 30% случаев процесс миелопоэза становится со временем полностью бесконтрольным, количество бластных форм кровяных клеток увеличивается, вытесняя нормальные, зрелые клетки. Когда количество бластов в крови превышает 20% (ранее пороговым значением было 30%), ставится диагноз острого миелоидного лейкоза.
В зависимости от того, известна ли причина нарушения функции костного мозга, или нет, МДС делится на первичный, или идиопатический, и вторичный. Вторичный возникает в результате угнетения костномозговой функции после химиотерапевтического или лучевого воздействия. Такое воздействие обычно является частью противоопухолевой терапии, т. е. проводится по поводу какого-либо вида рака. В этом случае МДС можно рассматривать как осложнение.
Первичный, или идиопатический МДС возникает спонтанно, без какой-либо предшествующей патологии и по неизвестной причине. Возможно, предрасполагающим фактором является генетический, поскольку при некоторых видах синдрома обнаруживаются хромосомные изменения.
Факторами, способствующими развитию МДС, являются:
Формы заболевания
Как уже указывалось выше, МДС делится на два вида, первичный и вторичный.
Чаще встречается первичный МДС (около 80% всех случаев), большинство заболевших – пожилые люди (65-75 лет). Вторичным МДС также в основном страдают пожилые люди, по той причине, что и злокачественные опухоли, а значит, и их осложнения, у них встречаются чаще. Вторичный МДС хуже поддается терапии и связан с худшим прогнозом.
Кроме того, МДС делится на клинические типы в зависимости от типа бластных клеток, их количества и наличия хромосомных изменений, эта классификация предложена Всемирной Организацией Здравоохранения (ВОЗ). Согласно классификации ВОЗ, выделяют следующие формы МДС:
Стадии заболевания
В протекании МДС выделяют три стадии, которые, однако, не всегда клинически четко отличаются между собой, различия определяются лабораторно. Это стадия анемии, стадия трансформации (промежуточная между анемией и острым лейкозом), и острый миелоидный лейкоз. Не все исследователи согласны с определением острого миелоидного лейкоза как стадии миелодиспластического синдрома, поскольку он относится к миелопролиферативным нарушениям (т. е. тем, которые характеризуются бесконтрольным клеточным ростом), тем самым не полностью соответствуя характеристикам МДС.
Симптомы
Основные симптомы МДС связаны с проявлениями анемии. Пациенты предъявляют жалобы на повышенную утомляемость, приступы головокружения, одышку при физической нагрузке, которая ранее переносилась легко. Анемия связана с нарушением продукции эритроцитов, следствием чего является низкий уровень гемоглобина в крови.
В некоторых случаях развивается геморрагический синдром, который характеризуется повышенной кровоточивостью. Пациент начинает замечать, что даже незначительные поверхностные повреждения вызывают длительно не останавливающееся кровотечение, может появиться кровоточивость десен, частые и спонтанные носовые кровотечения, петехии на коже и слизистых оболочках, а также множественные гематомы (синяки) либо без связи с какой-либо запоминающейся пациенту травмы, либо после незначительного ушиба или даже надавливания. Геморрагический синдром связан с нарушениями тромбоцитопоэза.
У больных с МДС также обнаруживается подверженность инфекционным болезням. Они часто болеют простудными заболеваниями, кожными бактериальными и грибковыми инфекциями. Такое состояние обусловлено нейтропенией (недостаточностью нейтрофилов).
Кроме того, признаками МДС могут быть:
В ряде случаев МДС ничем себя не проявляет и обнаруживается случайно во время лабораторного исследования крови по другому поводу.
Диагностика
Основной метод диагностики МДС – лабораторный. При подозрении на миелодисплазию проводятся:
Диагностические критерии
Для определения МДС разработаны специальные критерии, т. е. условия, при соблюдении которых ставится данный диагноз. Диагностические критерии следующие:
Цитопения должна быть стабильной и наблюдаться в течение не менее шести месяцев, однако если обнаруживается специфический кариотип, или ей сопутствует дисплазия не менее двух ростков кроветворения, достаточно двух месяцев.
Для постановки диагноза должны быть исключены другие заболевания, сопровождающиеся клеточной дисплазией и цитопенией.
При выявлении цитопении без других признаков МДС диагностируют идиопатическую цитопению, значение которой не установлено; при выявлении дисплазии без цитопении – идиопатическую дисплазию, значение которой не установлено. При этом требуется постоянное наблюдение пациента с повторным исследованием костного мозга через 6 месяцев, поскольку оба этих диагноза способны прогрессировать до МДС и острого миелоидного лейкоза (или другого миелопролиферативного заболевания).
Дифференциальная диагностика
МДС дифференцируется со следующими заболеваниями:
Лечение
В 1997 году была разработана специальная шкала, называемая шкалой IPSS (International Scoring Prognostic System, Международная шкала оценки прогноза), разделяющая пациентов на группы риска. В соответствии с определенной группой риска выбирается лечебная тактика, и, что следует из названия, оценивается прогноз.
Баллы присваиваются с учетом трех факторов:
Миелодиспластические синдромы (D46)
Миелодиспластический синдром, связанный с алкилирующим агентом
Миелодиспластический синдром, связанный с эпиподофиллотоксином
Миелодиспластический синдром, связанный с терапией БДУ
Исключено: медикаментозная апластическая анемия (D61.1)
Без сидеробластов, без избытка бластов
Хронический миеломоноцитарный лейкоз (C93.1)
Предлейкоз (синдром) БДУ
Алфавитные указатели МКБ-10
Внешние причины травм — термины в этом разделе представляют собой не медицинские диагнозы, а описание обстоятельств, при которых произошло событие (Класс XX. Внешние причины заболеваемости и смертности. Коды рубрик V01-Y98).
Лекарственные средства и химические вещества — таблица лекарственных средств и химических веществ, вызвавших отравление или другие неблагоприятные реакции.
В России Международная классификация болезней 10-го пересмотра (МКБ-10) принята как единый нормативный документ для учета заболеваемости, причин обращений населения в медицинские учреждения всех ведомств, причин смерти.
МКБ-10 внедрена в практику здравоохранения на всей территории РФ в 1999 году приказом Минздрава России от 27.05.97 г. №170
Выход в свет нового пересмотра (МКБ-11) планируется ВОЗ в 2022 году.
Сокращения и условные обозначения в Международой классификации болезней 10-го пересмотра
БДУ — без дополнительных уточнений.
НКДР — не классифицированный(ая)(ое) в других рубриках.
† — код основной болезни. Главный код в системе двойного кодирования, содержит информацию основной генерализованной болезни.
* — факультативный код. Дополнительный код в системе двойного кодирования, содержит информацию о проявлении основной генерализованной болезни в отдельном органе или области тела.
Миелодиспластические синдромы (МДС)
Миелодиспластические синдромы (МДС) – разнородная группа хронических заболеваний крови, при которых происходит нарушение созревания клеток крови, с возможным переходом в лейкоз.
Ранее МДС имел различные названия (малопроцентный острый лейкоз, предлейкоз, тлеющая лейкемия и др.).
Заболеваемость МДС составляет 3-5 случаев на 100 тысяч населения в год. Более 85% пациентов старше 60 лет, причем риск развития заболевания с возрастом увеличивается. В 2/3 случаев МДС носит вторичный характер и развивается на фоне других заболеваний крови (множественная миелома, лимфогранулематоз, неходжкинские лимфомы, хронический лимфолейкоз) и после цитостатической терапии при ревматоидном артрите, системной красной волчанке, хроническом гломерулонефрите.
Причина заболевания окончательно не выяснена, определенную роль играют ионизирующее излучение, прием цитостатические препараты, производные бензола.
ДИАГНОСТИКА
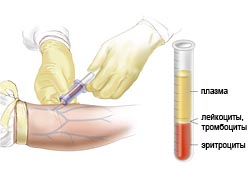
Клинический анализ крови позволяет выявить анемию (малокровие), которая является самым частым симптомом МДС и обнаруживается в 85-90% случаев, лейкопению (снижение числа лейкоцитов), выявляемую у 50% больных и тромбоцитопению (снижение количества тромбоцитов), проводящую к кровотечениям.
Цитогенетический анализ позволяет определить изменения в хромосомном аппарате клеток крови и является ключевым методом диагностики и определения прогноза заболевания.
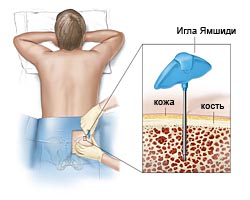
Аспирация (пункция костного мозга) и биопсия (трепанобиопсия) костного мозга – получение небольшого количества (0,2-0,5 мл) аспирата костного мозга и небольшого фрагмент кости. Процедура абсолютно безопасна и выполняется под местной анестезии в течение 2-5 мин. Может также проводиться амбулаторно. Исследования материала биопсий позволяют выявить изменения в костном мозге характерные для МДС.
У 20% пациентов можно выявить увеличение размеров селезенки, печени.
Выбор лечения определяется вариантом заболевания, прогнозом а также наличием сопутствующих заболеваний, которые могут существенно повлиять на терапию.
При благоприятном прогнозе и минимальных проявлениях заболевания можно ограничиться наблюдением за больным, пока показатели крови и костного мозга остаются стабильными.
При выраженном малокровии (анемии) показано переливание эритроцитарной массы, а при повышенной кровоточивости переливание тромбомассы. В ряде случаев возможно применение ростовых факторов (колониестимулирующие факторы).
Единственным методом лечения, позволяющим существенно увеличить продолжительность жизни больных МДС, является аллогенная трансплантация костного мозга/периферических стволовых клеток, Однако применение аллогенной трансплантации не всегда возможно в связи с пожилым возрастом большинства больных и отсутствием идентичного родственного донора.
До настоящего времени результаты лечения больных МДС остаются неудовлетворительными, в связи с этим не существует общепринятых стандартов лечения, а определены лишь общие подходы к терапии для разных групп больных при разных вариантах заболевания. Поэтому сохранение качества жизни пациентов с МДС в большинстве случаев, выходит на первый план при проведении лечения.
Миелодиспластический синдром у детей. Клинические рекомендации.
Миелодиспластический синдром у детей
Оглавление
Ключевые слова
Трансплантация гемопоэтических стволовых клеток
Список сокращений
МДС – миелодиспластический синдром
ЩФ – щелочная фосфотаза
АЧТВ – активированное частичное тромбопластиновое время
ПИ – протромбиновый индекс
МНО – международное нормализованное отношение
ALIP –атипичное скопление миелоидных предшественников
ТГСК – трансплантация гемопоэтических стволовых клеток
РАИБ – рефрактерная анемия с избытком бластов (RAEB)
HLA – лейкоцитарные антигены главного комплекса гистосовместимости
Термины и определения
Клинические проявления обусловлены анемией и/или симптомами, связанными с перегрузкой железом в результате частых трансфузий.
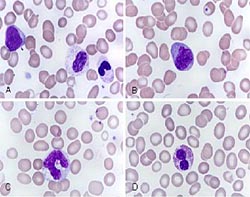
Большая популяция эритроцитов представлена в основном нормохромными клетками, а также небольшой популяцией гипохромных клеток; отмечается анизохромия. К/м гиперклеточный: отмечается гиперплазия эритроидного ростка. 15% и более эритроидных предшественников относятся к кольцевидным сидеробластам (кольцевидные сидеробласты представляют собой эритроидные предшественники, в которых 1/3 и более ядра окружены 10 и более железосодержащими гранулами). Дисплазия изолированно затрагивает эритроидную линию и проявляется не только наличием кольцевидных сидеробластов, но и дольчатостью ядра и мегалобластоидностью. Число бластных клеток не превышает 5%.
Необходимо отметить, что кольцевидные сидеробласты, иногда свыше 15%, могут наблюдаться и при других формах МДС, в том числе при РАИБ.
Клональные хромосомные аномалии наблюдаются менее, чем в 10% случаев [25]. Приблизительно 1-2% случаев с монолинейной дисплазией эволюционируют в ОЛ. Медиана общей выживаемости составляет приблизительно 6 лет [55].
РЦМД – это форма МДС с би- или панцитопенией, диспластическими изменениями в 10% и более клеток, затрагивающими две или более миелоидные линии [26]. Бластные клетки в периферической крови составляют менее 1% и менее 5% в к/м; палочки Ауэра отсутствуют, уровень моноцитов в периферической крови всегда составляет менее 1х109/л.
Клинические проявления заболевания обусловлены степенью цитопении.
Клональные хромосомные аномалии встречаются в 50% случаев и включают в себя трисомию 8-й хромосомы, моносомию 7-й, del 7q, моносомию 5-й хромосомы, del 5q и del 20q, а также комбинированные цитогенетические аномалии.
Прогноз заболевания во многом определяется степенью цитопении и дисплазии. Эволюция в ОЛ возникает приблизительно в 11% случаев [55].
Медиана общей выживаемости составляет приблизительно 33 месяца. Выживаемость у больных с комбинированными цитогенетическими аномалиями приближается к таковой при РАИБ.
Клинически заболевание проявляется симптомами, связанными с к/м недостаточностью, включая анемию и/или тромбоцитопению, и/или нейтропению.
В периферической крови отмечается вовлечение в диспоэз всех трех ростков кроветворения: анизопойкилоцитоз с макроцитами, атипичные тромбоциты, гипогрануляция и гипосегментация ядер в нейтрофилах. Уровень бластных клеток в крови составляет от 0 до 19%. К/м в большинстве случаев гиперклеточный (лишь в 10-15% отмечается гипоклеточность), выявляется аномальная локализация незрелых миелоидных предшественников (ALIP). Диспоэз может затрагивать все клеточные линии.
Иммунофенотип бластных клеток характеризуется экспрессией 1 или более миелоидных анитигенов, включая CD 13, CD33, CD 117.
РАИБ сопровождается прогрессией к/м недостаточности; приблизительно 25% случаев РАИБ-1 и 33% РАИБ-2 прогрессируют в острый лейкоз; остальные пациенты погибают от к/м недостаточности. Медиана выживаемости составляет приблизительно 18 месяцев для РАИБ-1 и 10 месяцев для РАИБ-2 [55].
Специфические морфологические находки отсутствуют. Отмечается нейтропения или тромбоцитопения. Дисплазия ограничена одной клеточной линией, однако может быть значимой. К/м обычно гиперклеточный. Специфических цитогенетических находок нет. Выживаемость, а также количество случаев с эволюцией в ОЛ неизвестны.
Клинически заболевание проявляется анемией, которая может быть очень тяжелой. В редких случаях отмечается значимое повышение числа тромбоцитов.
Анемия носит макроцитарный характер. Может отмечаться легкая лейкопения. Уровень тромбоцитов в основном нормальный, в редких случаях повышен. К/м обычно гиперклеточный; выраженность диспоэза в эритроидном ростке представлена в разной степени. Нередко диспоэз отмечается в тромбоцитарном ростке (гиполобулярность ядер; микроформы).
Единственная цитогенетическая аномалия представлена делецией в области q 31 и q33 5-й хромосомы. Размер делеции и точка разрыва варьируют. При обнаружении дополнительных аномалий заболевание относят к другой категории.
Дополнительные цитогенетические аномалии ассоциированы с эволюцией в острый лейкоз.
В педиатрической практике крайне редко встречаются рефрактерная анемия с кольцевидными сидеробластами, которая у взрослых составляет 25% от всех форм МДС, и синдром 5q-; в то время, как моносомия 7-й хромосомы, наоборот, является наиболее частой цитогенетической аномалией у детей с этой патологией. Комбинированные аномалии также чаще наблюдаются у детей – до 1/3 случаев в отличие от взрослых.
1. Краткая информация
1.1 Определение
Миелодиспластический синдром (МДС) – это группа клональных заболеваний стволовой клетки, которая характеризуется дисплазией и неэффективным гемопоэзом в одной или более миелоидных клеточных линиях. Дисплазия может сопровождаться увеличением числа миелобластов, однако, их уровень не превышает 20%. 4.
1.2 Этиология и патогенез
Этиология МДС мультифакторная,, не исключена роль внешних факторов окружающей среды (ионизирующее излучение, химические агенты и др.), но основную роль играет генетическая предрасположенность. Описаны различные синдромы у детей, ассоциированные и предрасполагающие к развитию МДС, например, нейрофиброматоз I типа, анемия Фанкони, тяжелая врожденная нейтропении (синдром Костмана), синдрома Дауна или синдрома Нунана [6,7]. Этиологические факторы, специфичные для МДС, на сегодняшний день не установлены.
Патогенез МДС является результатом многоступенчатого процесса, характеризующегося аккумуляцией генетических повреждений. Хотя природа инициальных и последующих мутаций в данной группе не известна, при цитогенетическом и молекулярном анализе у пациентов с МДС обнаруживаются аберрации 11.
1.3 Эпидемиология
МДС является редким заболеванием и составляет 4% от всех злокачественных гематологических заболеваний, ежегодная заболеваемость 1,8 на 1 млн детей в возрасте от 0 до 14 лет [1,16,17].
1.4 Кодирование по МКБ-10
D 46 – Миелодиспластический синдром
1.5 Классификация
Классификация миелодиспластического синдрома [1,6,18-20]:
Рефрактерная анемия
Рефрактерная анемия с кольцевидными сидеробластами
Рефрактерная цитопения с мультилинейной дисплазией
Рефрактерная цитопения с мультилинейной дисплазией и кольцевидными сидеробластами
МДС, ассоциированный с изолированной делецией длинного плеча 5 хромосомы (5q- синдром)
Рефрактерная анемия с избытком бластов – 2
Необходимо отметить, что МДС, развившиеся на фоне врожденных заболеваний с костно-мозговой недостаточностью, сложно классифицировать согласно FAB критериям.
В классификации, предложенной ВОЗ (Стокгольм, 2001) выделены 3 группы синдромов [6,15,18,20-22]:
Миелодиспластические/миелопролиферативные заболевания
А. Ювенильный миеломоноцитарный лейкоз
Б. Хронический миеломоноцитарный лейкоз
В. Хронический миелоидный лейкоз, РН-негативный
Синдром Дауна
А. Транзиторное нарушение миелопоэза
Б. Миелодиспластический синдром/острый миелоидный лейкоз
МДС sui generis (своеобразный)
А. Рефрактерная цитопения (менее5% бластов в костном мозге)
Б. Рефрактерная анемия с избытком бластов (5-20% бластов)
2. Диагностика
2.1 Жалобы и анамнез
Основными жалобами при МДС являются слабость, утомляемость, бледность кожных покровов, слизистых, головокружения, повышенная кровоточивость (носовые, десневые), симптомы интоксикации (в частности, повышение температуры, повышенное потливость, снижение массы тела), наличие очагов инфекции, но в ряде случаев жалобы могут отсутствовать [1,2,4-6,17].
При сборе анамнеза необходимо обратить внимание на семейный анамнез (семейные формы МДС, а также наличие других онкологических заболеваний в семье), длительность заболевания (обычно речь идет о длительном анамнезе) и основные клинико- лабораторные характеристики в дебюте заболевания (нередко в дебюте отмечаются одно/двухлинейные цитопении, рефрактерные к проводимой терапии: витаминотерапии, гормональной терапии, терапии препаратам железа [1,4,17].
2.2 Физикальное обследование
Общий осмотр на первом этапе постановки диагноза позволяет с большой вероятностью исключить наследственные формы апластической анемии (анемия Фанкони, врожденный дискератоз), выявить изменения, характерные для острых лейкозов и солидных опухолей, а также оценить тяжесть состояния пациента, что определяется степенью выраженности анемического, геморрагического синдромов, наличием симптомов интоксикации и очагов инфекции [1,17]. При различных формах МДС характерных симптомов нет, диапазон клинических проявлений определяется сочетанием и выраженностью вовлечения тех или иных ростков кроветворения в патологический процесс.
физическое и психомоторное развитие ребенка;
наличие стигм дисморфогенеза;
наличие аномальной пигментации кожных покровов;
наличие и степень выраженности гепатоспленомегалии;
паранеопластические симптомы, например реактивный артрит.
2.3 Лабораторная диагностика
Рекомендуется общий клинический анализ крови [1,5,17,23]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Рекомендуется биохимический анализ крови [17,23].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарии: биохимическое исследование крови должно проводится всем пациентам, несмотря на отсутствие специфических для МДС изменений. Необходимо исследовать уровни ЛДГ, АЛТ, АСТ, ЩФ, мочевины, креатинина, глюкозы, К+, Na+, Са+, сывороточного железа с целью исключения сопутствующей патологии, которые могут выявляться в рамках врожденных или наследственных заболеваний/синдромов.
Рекомендуется морфологическое и цитохимическое исследование костного мозга [10,17,21,23-24].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарии: Данное исследование является обязательным и выполняется пациентам под общей анестезией. Проводится пункция костного мозга из четырех точек (передние и задние ости подвздошной кости). Из каждой «точки» изготавливается по 10 мазков. Три мазка из каждой точки окрашиваются азур-эозином по Романовскому-Гимзе. При анализе миелограммы необходимо оценить следующие показатели: клеточность костного мозга (нормоклеточный, гипоклеточный, гиперклеточный); соотношение основных ростков кроветворения: гранулоцитарного, эритроидного, мегакариоцитарного (сужение, расширение, нормальный уровень); клеточный состав, уровень бластных клеток, их морфологическая характеристика и принадлежность к определенной клеточной линии; наличие и относительное (%) содержание кольцевидных сидеробластов от клеток эритроидного ряда; наличие диспоэза (дисплазия должна быть выявлена в 10 и более % клеток, морфологические характеристики диспоэза и степень вовлеченности ростков кроветворения.
Рекомендуется цитогенетическое исследование костного мозга [1,17]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарии: Выполняются в обязательном порядке всем пациентам, в том числе с целью исключения наследственных форм апластической анемии, выявлении изменений характерных для острого лейкоза и солидных опухолей.
Рекомендуется трепанобиопсия костного мозга [4,6,10,23]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Рекомендуется определение группы крови и резус-фактора
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарии: Данное исследование является обязательным при любой соматической патологии, особенно со стороны кроветворной системы. Поскольку МДС сопровождается различной степенью цитопении, пациенту может потребоваться заместительная терапия препаратами крови.
Рекомендуется HLA-типирование пациентов и родственников
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарии: Выбор донора гемопоэтических стволовых клеток, оптимально соответствующего реципиенту, является одним из основных условий успешности проведения ТГСК. Среди потенциальных доноров, помимо аллогенного, могут рассматриваться родители, сиблинги (братья и сестры), другие ближайшие родственники (тети, дяди, двоюродные братья и сестры) с учетом результатов HLA-типирования.
Рекомендуется коагулограмма (фибриноген, АЧТВ, ПИ, МНО)
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарии: Представленный набор скрининговых показателей достаточен для оценки гемостаза на начальном этапе. При наличии изменений представленных показателей следует проводить более детальное исследование (факторы, агрегация и др.).
Рекомендуется серологическое исследование маркеров гепатитов B,C,D
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарии: скрининговый тест
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Комментарии: Необходимые исследования, которые выполняются с целью исключения врожденных иммунодефицитных состояний, которые могут сопровождаться цитопениями и диспоэзом.
Рекомендуется Проба Кумбса
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Комментарии: Данное исследование позволяет исключить аутоиммунную гемолитическую анемию как самостоятельное заболевание, так и развивающееся в рамках врожденных иммунодефицитных состояниях.
Рекомендуется Проба с ДЭБ
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Комментарии: Проба с диэпоксибутаном (ДЭБ) является золотым стандартом исключения анемии Фанкони. Определяет частоту и спектр спонтанных и индуцированных in vitro хромосомных аббераций.
Рекомендуется Электрофорез гемоглобина
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Комментарии: повышение HbF возможно при различных формах МДС, что может дополнительно указывать на вовлеченность эритроидного ростка в патологический процесс с перестройкой на фетальный тип эритропоэза. Кроме того, данное исследование позволяет исключить иные формы недостаточности костного мозга.
2.4 Инструментальная диагностика
Инструментальная диагностика необходима с целью исключения других заболвеаний, в том числе, онкологических, а также сопутствующей патологии для проведения грамотной сопроводительной терапии.
Рекомендуется ультразвуковое исследование органов брюшной полости, средостения, забрюшинного пространства и малого таза.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарии: Проведение исследования необходимо всем пациентам с целью выявления гепатоспленомегалии, лимфаденопатии, портальной гипертензии и иной патологии.
Рекомендуется рентгенография органов грудной клетки
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарии: Рентгенография органов грудной клетки проводится в двух проекциях для исключения инфильтративных изменений легочной ткани. Рентгенография отдельных участков скелета выполняется по показаниям.
Рекомендуется компьютерная рентгеновская томография грудной клетки
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарии: Данное исследование необходимо при наличии патологических изменений на рентгенограмме органов грудной клетки.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарии: Стандартная ЭКГ проводится с целью исключения сердечной патологии, в том числе нарушений ритма и проводимости в сердечной мышце.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарии: Проводится при наличии признаков сердечной недостаточности, снижении сократимости, легочной гипертензии, пороков сердца, а также перед проведением высокодозной химиотерапии с использованием кардиотоксичных препаратов.
2.5 Иная диагностика
Иная диагностика не предусмотрена.
3. Лечение
Цель лечения: Выздоровление [4,6,27]
Единиственным эффективным методом терапии при МДС являеться ТГСК, и именно этот метод должен рассматриваться в качестве терапии выбора при всех формах МДС. Терапевтическая стратификация проводится на основании наличия в семье HLA-совместимого донора.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
3.1. Сопроводительная терапия
Заместительная терапия компонентами крови (эритроцитами, тромбоцитами);
Хелаторная терапия (при перегрузке железом после множественных трансфузий) – дефероксамин, деферазирокс;
Факторы роста – Г-КСФ, эритропоэтин, тромбопоэтин
Противомикробная (антибактериальная, противогрибковая).
Необходимость и длительность сопроводительной терапии определяет врач.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
3.2 Хирургическое лечение
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
3.3 Иное лечение
4. Реабилитация
Специфических реабилитационных мероприятий в отношении детей с МДС не разработано.
5. Профилактика и диспансерное наблюдение
Специфических профилактических мероприятий в отношении детей с МДС не разработано.
Объем необходимого обследования определяется наличием возникших осложнений в ходе проведенного основного лечения (в частности, наличия реакции трансплантат против хозяина).
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
6. Дополнительная информация, влияющая на течение и исход заболевания
Большинство классификаций в качестве прогностических факторов учитывают, прежде всего, недостаточность к/м кроветворения и относительное содержание бластных клеток.
Ранее предложенная система прогнозирования IPSS не позволяет прогнозировать заболевание у детей. Проанализированные данные по МДС у детей показали, что с плохой выживаемосью коррелирует двух-трехлинейная цитопения и уровень бластных клеток свыше 5% в к/м, в то время как цитогенетические аномалии имеют меньшую прогностическую значимость.
Прогрессия заболевания может происходить быстро, в случаи ее развития прогноз очень плохой. В связи с этим рекомендуется проведение ранней ТГСК.
Критерии оценки качества медицинской помощи
Критерии качества
Уровень достоверности доказательств
Уровень убедительности рекомендаций
Выполнен общий клинического анализ крови
Выполнен биохимический анализ крови с обязательным определением уровня ЛДГ, АЛТ, АСТ, ЩФ, мочевины, креатинина, глюкозы, К+, Na+, Са+
Выполнено определение группы крови и резус-фактора
Выполнена коагулограмма с определением следующих показателей: уровня фибриногена, АЧТВ, ПИ, МНО
Выполнено HLA – типирование пациента и сиблингов
Выполнено серологическое исследование маркеров гепатитов B,C,D
Выполнено УЗИ органов брюшной полости, средостения, забрюшинного пространства и малого таза