болезнь ормонда код мкб 10
Болезнь Ормонда – это вариант мезинхимопатии, неспецифический фибросклеротический процесс, развивающийся в соединительной ткани забрюшинного пространства. Проявления обусловлены сдавлением мочеточников, сосудов и почек. Основные симптомы – поясничные и абдоминальные боли, дискомфорт в паховой области. В запущенных случаях присоединяется ХПН, наблюдаются отеки, тошнота, снижение диуреза. Диагноз подтверждают данные КТ, МРТ, ПЭТ и морфологического исследования, определения уровня IgG4. Лечение консервативное (гормонотерапия), при нарушении уродинамики – оперативное.
МКБ-10
Общие сведения
Забрюшинный фиброз впервые описал французский исследователь И. Альбарран в начале XX века, более объемную работу по изучению патологии провел американский уролог Д.К. Ормонд в 1948 году. Специалисты в сфере современной урологии рассматривают большинство случаев болезни как иммунозависимую системную патологию, ассоциированную с иммунными комплексами IgG4-СЗ, характеризующуюся тотальной или частичной воспалительной инфильтрацией органов и тканей плазматическими клетками. Именно они вырабатывают IgG4, что инициирует облитерирующий флебит и фибросклероз. Болезнь Ормонда – частный случай мезинхимопатии, аналогичные изменения регистрируются в других органах и системах. Патологию чаще диагностируют у мужчин старше 50 лет.
Причины
Причины забрюшинного фиброза до настоящего времени остаются дискутабельными. Считается, что этиологические факторы провоцируют иммунный ответ, что способствует воспалительному поражению брюшины, исходом которого становится фиброз. Агрессивность патологии различается, причины вариативности неизвестны. Основным патогенетическим триггером называют повышенную экспрессию комплекса IgG4 плазматическими клетками. Болезнь Ормонда может быть вторичной, специалисты выделяют ряд состояний, которые потенциально приводят к ретроперитонеальному фиброзу:
К предрасполагающим факторам относят курение, воздействие асбеста. Наличие нескольких больных в пределах одной семьи указывает на возможную роль генетических факторов. У некоторых пациентов, страдающих фибросклерозом Ормонда, выявляют человеческий лейкоцитарный антиген HLA–B27 (иммуногенетический маркер), носительство которого свидетельствует о предрасположенности к аутоиммунным заболеваниям, включая забрюшинный фиброз. Существуют и другие генетические ассоциации, повышающие вероятность патологии.
Патогенез
По последним данным, в 50-75% болезнь Ормонда связана с присутствием плазматических клеток, продуцирующих IgG4. Патология чаще проявляется системно, аналогичные изменения тканей почти всегда выявляют в поджелудочной железе, лимфатических узлах, гипофизе. Наблюдается опухолевидный отек вовлеченных органов, лимфоплазматическая инфильтрация и фиброзно-склеротический процесс различной степени выраженности. Измененная клетчатка сдавливает мочеточник, крупные магистральные сосуды, лимфатические пути, реже – почки.
Забрюшинный фиброз как следствие злокачественных новообразований, составляет 8-10% от общего числа случаев болезни. Активному синтезу коллагена способствует десмоплазия (образование волокнистой соединительной ткани как ответ на присутствие раковых клеток в забрюшинном пространстве) либо первичная опухоль, например, лимфома, саркома или метастатические поражения из других органов: желудка, простаты, почек.
Инфильтрат состоит из многочисленных лимфоцитов, плазматических клеток, макрофагов, иногда нейтрофилов. Воспалительные клетки вкраплены в коллагеновые пучки, организованы узловыми скоплениями вокруг мелких сосудов. Патология классифицируется как связанная с IgG4 при наличии сториформного фиброза, инфильтрации эозинофилов, облитерирующего флебита. Тучные клетки находятся в дегранулированном состоянии, что согласуется с их активным участием в фиброзно-воспалительной реакции.
Классификация
Забрюшинный фиброз может быть изолированным, связанным с аутоиммунными болезнями, или возникшим на фоне многоочагового фиброзно-воспалительного заболевания, ассоциированного с IgG4. Поражение чаще затрагивает оба мочеточника. Стандартизированные критерии для классификации ретроперитонеального фиброза отсутствуют, патология рассматривается в одном ряду с хроническим периаортитом, перианевризматическим фиброзом и воспалительными аневризмами брюшной аорты, которые имеют общие гистологические и клинические признаки. Формы ретроперитонеального фиброза:
Симптомы болезни Ормонда
Вначале в 60-90% случаев наблюдаются системные симптомы: слабость, анорексия, потеря веса. Клинические проявления развернутой формы многообразны, включают дискомфорт в поясничной области, животе и над лоном (70-90%). Боль обычно тупая, не изменяется в зависимости от положения тела, временно реагирует на нестероидные противовоспалительные средства. При поражении мочеточника имитирует почечно-мочеточниковую колику, для которой типичны резкая болезненность, положительный симптом поколачивания, рвота.
Компрессия сосудов проявляется гидроцеле и варикоцеле (30%). Характерны жалобы на дискомфорт в промежности, чувство распирания мошонки. Сдавление нижней полой вены и лимфатических путей вызывает отеки нижних конечностей и хромоту у каждого десятого больного. При вовлечении почечных артерий возникает рено-сосудистая гипертензия. Повышение давления носит устойчивый характер. При существовавшей ранее гипертонии ее течение ухудшается. Высокое давление при постановке диагноза выявляют у трети пациентов.
Осложнения
Осложнения заболевания весьма серьезны, связаны с высокой летальностью (10-20%). Сужение просвета мочеточников и их гипотония приводят к рецидивирующему пиелонефриту, гидронефротической трансформации почек (55-100%), хронической почечной недостаточности (40-90%). У 32% больных диагностируют атрофию почки, связано ли это с обструкцией мочеточника, стенозом почечной артерии или другими причинами – остается неясным. Часто после поражения одного мочеточника другой вовлекается в процесс в период от нескольких недель до нескольких лет.
Тромбоз глубоких вен и легочная эмболия – грозные осложнения венозной компрессии при синдроме Ормонда – встречаются редко, что обусловлено компенсаторными возможностями организма (формированием коллатеральных путей для оттока крови). При забрюшинном фибросклерозе могут поражаться брыжеечные и чревные артерии с развитием стеноза и ишемических осложнений, напоминающих брыжеечный васкулит. У 30% больных ретроперитонеальным фиброзом изменена грудная аорта, что может привести к ее аневризме.
Диагностика
Аутоиммунное склерозирующее заболевание сложно заподозрить из-за многообразия жалоб. Изменения в анализах неспецифичны, встречаются при других патологиях. Нередко недообследованные пациенты получают неполноценное лечение у уролога или гастроэнтеролога, что ухудшает прогноз. Доказано, что на начальной стадии можно добиться ремиссии болезни с помощью исключительно консервативной терапии, поэтому специалисты считают приоритетным раннее выявление патологического процесса. Алгоритм обследования при забрюшинном фиброзе Ормонда включает:
Дифференциальную диагностику проводят с опухолями забрюшинного пространства, обструктивной уропатией другого генеза (при нефролитиазе, лучевых повреждениях, неспецифическом уретерите). Схожая картина наблюдается при воспалительных процессах клетчатки, посттравматических состояниях и новообразованиях мочеточника. Дифференциальный диагноз между идиопатическим, связанным с IgG4, и вторичным фибросклерозом имеет решающее значение, поскольку тактика ведения может кардинально различаться.
Лечение болезни Ормонда
Лечебные мероприятия направлены на сохранение функциональной способности органов мочевыделения, предотвращение распространения патологического процесса на соседние структуры, облегчение или купирование неблагоприятных симптомов. Тактика лечения (консервативное или хирургическое с приемом лекарств) зависит от стадии ретроперитонеального фиброза. При отсутствии уропатии и выраженного сдавления сосудов возможна медикаментозная терапия с обязательным наблюдением (КТ, МРТ и УЗИ органов брюшной полости и почек, оценка СОЭ, уровня С-реактивного белка).
Консервативная терапия
Консервативное лечение позволяет добиться положительной динамики у 80-83% пациентов. Эффект кортикостероидов обусловлен их противовоспалительным действием, способностью замедлять созревание соединительной ткани. Тамоксифен назначают при наличии противопоказаний к кортикостероидам или одновременно с гормональными средствами. Комбинация глюкокортикоидов с азатиоприном наиболее полезна при воспалении. Азатиоприн также применяют в качестве иммуносупрессивного препарата при неэффективности глюкокортикоидной терапии. Иммунодепрессант микофенолат угнетает синтез пурина и пролиферацию лимфоцитов.
Оперативные вмешательства
Обструктивная уропатия с нарушениями уродинамики и тенденцией к гидронефрозу почек подразумевает решение вопроса об отведении мочи. Первичное лечение забрюшинного фиброза включает уретеролиз, латеральную или внутрибрюшинную транспозицию мочеточников, их изоляцию. Далее обязательно проводят курс противорецидивной терапии, позволяющий снизить вероятность рецидивирования с 50 до 10%.
Экспериментальные способы
В последнее время начали применять эффективные экстракорпоральные методы терапии, основанные на выведении из крови болезнетворных и токсичных субстанций. Существует несколько вариантов: плазмаферез, лимфоцитаферез (отдельное извлечение лимфоцитарных клеток), каскадная фильтрация плазмы. Хорошие результаты получают при перфузии жидкой части крови через носитель, отсекающий соответствующие антитела.
Из новых лекарственных препаратов, обеспечивающих улучшение при идиопатических и IgG4-связанных патологиях, выделяют ритуксимаб (моноклональные антитела, полученные методом генной инженерии). Его назначают в качестве монотерапии или в комбинации с кортикостероидами. Ритуксимаб используют в профилактических целях по достижении ремиссии. Крупные рандомизированные исследования не проводилось, подходы к терапии во многом находятся на стадии разработки.
Прогноз и профилактика
Если болезнь диагностирована на ранней стадии с условием адекватной терапии, прогноз благоприятный. Гидронефроз и хроническая болезнь почек ухудшают исход. Улучшение функции почек происходит за 14-18 дней, далее пациенты подлежат тщательному наблюдению: сначала каждые три месяца, если нет отрицательной динамики – 1 раз в полгода. Забрюшинный фиброз, инициированный опухолевыми заболеваниями, имеет неблагоприятный прогноз с летальностью в течение полугода.
Профилактические мероприятия для предотвращения идиопатических форм заболевания не разработаны. Для предупреждения вторичного забрюшинного фиброза следует отказаться от курения, придерживаться здорового образа жизни. Недопустим прием лекарственных препаратов с превышением рекомендованных дозировок и длительности терапии, самолечение. Ранее обращение к специалисту при появлении неприятных симптомов, прохождение полной диагностики значительно увеличивает шансы на благоприятный исход – лечению лучше поддаются острые формы фиброза или существующие не более 6 месяцев.
Ормонда болезнь
РЕТРОПЕРИТОНЕАЛЬНЫЙ ФИБРОЗ (БОЛЕЗНЬ ОРМОНДА)
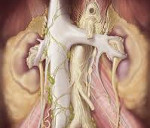
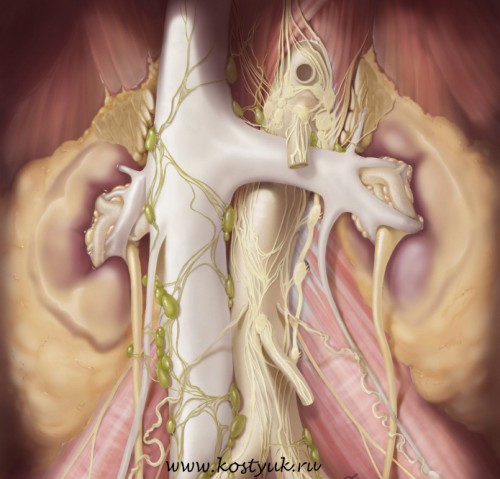
Ретроперитонеальный фиброз (позадибрюшинный фиброз, примочеточниковый фиброз, позадибрюшинная гранулёма, болезнь Ормонда) — хроническое неспецифическое негнойное воспаление фиброзно-жировой ткани неясной этиологии, вызывающее постепенную компрессию и нарушение проходимости тубулярных структур ретроперитонеального пространства (чаще всего мочеточников).
Заболевание представляет собой одно из проявлений широко распространённого понятия, определяемого как «системный идиопатический фиброз». Идиопатический медиастинальный фиброз, струму Риделя (Riedel), склерозирующий холангит, панникулит, болезнь Пейрони (Peyronie) и десмоидную опухоль относят к другим фиброматозам, которые представляют локализованные формы системного идиопатического фиброза.
Идиопатический РПФ (болезнь Ормонда) впервые описал Albarran (1905). В 1948 г, уролог из Балтимора Ормонд впервые описал заболевание, характеризуемое разрастанием плотной волокнистой соединительной ткани в ретроперитонеальной клетчатке, вызвавшее обструкцию мочеточников и применил для его обозначения термин «ретроперитонеальный фиброз» (РПФ).
ЭПИДЕМИОЛОГИЯ
РПФ встречается редко, заболеваемость им составляет примерно 1 на 200 000 человек. В 70% случаев это лица в возрасте от 30 до 60 лет. Мужчины болеют РПФ в 2 раза чаще, чем женщины. Смертность зависит от активности обструктивного процесса и осложнений, связанных с ним (сдавление мочеточников, ХПН, нефрогенная АГ, сдавление нижней полой вены, аорты и подвздошных артерий).
СКРИНИНГ
Проведение скрининга при массовом обследовании для диагностики РПФ не выявляет изменений, специфических для данного заболевания, но позволяет отметить нарушения пассажа мочи в виде уретерогидронефроза, а также деформацию мочеточников, что при наличии жалоб больного может стать необходимостью для дальнейшего углубленного обследования.
КЛАССИФИКАЦИЯ
Различают первичный (идиопатический) и вторичный РПФ. В развитии идиопатического РПФ ведущую роль отводят аутоиммунным механизмам. Вторичный РПФ — следствие разнообразных патологических состояний и болезней.
ЭТИОЛОГИЯ
Этиология заболевания не известна. Существует две основные теории его возникновения — воспалительная и иммунная. Некоторые исследователи относят данное заболевание к группе истинных коллагенозов.
Выделяют ряд факторов, способствующих возникновению заболевания: злокачественные новообразования, хроническое воспаление в печени, поджелудочной железе, склеротические процессы в забрюшинной клетчатке, возникающие при хронических заболеваниях кишечника, в женских половых органах, туберкулёзное поражение позвоночника и некоторые другие инфекции, облучение, посттравматические забрюшинные гематомы, системное поражение сосудов, токсическое воздействие ряда химиопрепаратов и применение некоторых лекарственных средств, в частности от мигрени. В 2/3 случаев причинный фактор установить не удаётся — заболевание имеет идиопатический характер.
ПАТОГЕНЕЗ
Обычно РПФ начинается в забрюшинной клетчатке, окружающей подвздошные сосуды, у места их перекрёста с мочеточником (уровень L4–L5). Постепенно фиброз распространяется к мысу крестца и области ворот почки. С боковой стороны процесс ограничен наружным краем поясничной мышцы. В 30% случаев процесс двусторонний Белая фиброзная ткань, напоминающая бляшку дерева, расположена вдоль периаортальных лимфатических узлов. В 30% случаев РПФ является двусторонним процессом. Окружающие лимфатические узлы ткани вовлечены в процесс и стянуты, но структуры, расположенные в забрюшинном пространстве, не поражены.. Сосуды и мочеточники вовлекаются в процесс настолько интимно, что не удаётся определить грань между адвентицией и фиброзной тканью.
При гистологическом исследовании изменённой клетчатки выявляют неспецифическое хроническое воспаление. Выделяют три фазы воспаления. Особенность первой фазы — наличие в ткани диффузной клеточной инфильтрации, состоящей из лимфоцитов, гистиоцитов и эозинофилов. Во вторую фазу происходят соединительнотканные фиброзные изменения с прогрессирующим развитием коллагеновых волокон. В третьей фазе начинается склерозирование жировой ткани. Фиброзная ткань может быть богата сосудами, в которых (преимущественно в мелких венах) имеются признаки прогрессирующего васкулита, т.е. для микроскопической картины характерно диффузное разрастание плотной волокнистой соединительной ткани. Среди рыхло расположенных коллагеновых волокон встречаются одиночные тучные клетки, а также одноядерные круглоклеточные инфильтраты, представленные лимфоидными плазматическими и эозинофильными клетками.
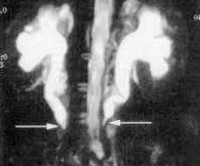
При невозможности выполнения ретроградной производят чрезкожную антеградную пиелоуретерографию. С помощью радиоинуклидного исследования оценивают функциональное состояние почек и верхних мочевыводящих путей. Ультразвуковое исследование подвздошных сосудов с цветным допплеровским картированием подтверждает расширение полости почки и мочеточника и выявляет прерывание мочеточника на уровне его перекреста с подвздошными сосудами. Определенное диагностическое значение имеет венокаваграфия. Для заболевания характерны сужение или обструкция нижней полой вены с развитием коллатералей, а также смещение её поясничного отдела кпереди. В последнее время для диагностики РПФ используют КТ и МРТ. Данные виды медицинского обследования позволяют выявить не только расширение верхних мочевыводящих путей, но и однородное объёмное образование, окружающее мочеточник, нижнюю полую вену и аорту. Учитывая, что РПФ может возникнуть вследствие воспалительных заболеваний соседних органов, целесообразно провести обследование органов брюшной полости и малого таза.
Уточнить диагноз и провести дифференциальную диагностику между злокачественным и доброкачественным РПФ можно с помощью анализа множественных глубоких биопсий этого образования. Несмотря на то, что не существует специфических лабораторных показателей, изменения которых связаны с развитием РПФ, примерно у 60–90 % пациентов повышается СОЭ, неспецифический индикатор воспаления.
Дополнительные методы исследования — УЗИ органов брюшной полости, ирригоскопия, колоноскопия, ректороманоскопия, почечная артериография, провокационная туберкулиновая проба.
В некоторых наблюдениях правильный диагноз удаётся установить только после лапаротомии и операционной биопсии.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Дифференциальную диагностику РПФ проводят со стриктурой или ахалазией мочеточников, с двусторонним гидронефрозом. В отличие от вышеперечисленных заболеваний для РПФ характерна обструкция мочеточников на уровне перекрёста с подвздошными сосудами, выше которого мочеточник расширен, а ниже — не изменён.
Бывают случаи, когда возникают трудности дифференциальной диагностики болезни Ормонда с атипичной локализацией кист поджелудочной железы, опухолей желудка и кишечника, с опухолями, расположенными ретроперитонеально, с туберкулёзом почек и мочеточников.
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА
Ретроперитонеальный фиброз. Двусторонний уретерогидронефроз. Хронический пиелонефрит, активная стадия. ХПН в интермиттирующей стадии. Нефрогенная гипертензия.
ЛЕЧЕНИЕ
Лечение зависит от причины развития заболевания. Если оно связано с применением лекарственных средств его отмена часто приводит к выздоровлению. Лечение при злокачественных заболеваниях проводят в соответствии с их клеточным типом. Идиопатический РПФ часто поддаётся лечению глюкокортикоидами и (или) дополнительными иммуносупрессорными препаратами. В то же время, пациентам, особенно при распространённом заболевании, часто необходимо оперативное вмешательство для освобождения мочеточников и других структур и уменьшения обструкции.
ЦЕЛИ ЛЕЧЕНИЯ
Лечение РПФ сводится к восстановлению и/или поддержанию проходимости верхних мочевыводящих путей с целью профилактики возможных осложнений. В зависимости от стадии заболевания и наличия осложнений проводят консервативное и оперативное лечение.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
РПФ с клиническими проявлениями заболевания является показанияем к госпитализации. Обычно больные поступают в урологический стационар по экстренным показаниям в связи с анурией или олигурией.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Консервативную терапию первичного РПФ как самостоятельный вид лечения применяют лишь при сохранности пассажа мочи и умеренной степени снижения тонуса верхних мочевыводящих путей и нарушения функции почек.
Для воздействия на периуретеральный фиброз используют глюкокортикоидные средства (дексаметазон, преднизолон) в сочетании с ( неспецифическими противовоспалительными средствами (НПВС) иммунодепрессантами (азатиоприн), препаратами рассасывающего действия (гиалуронидаза, алоэ, стекловидное тело,). Наиболее эффективно применение кортикостероидов в начальной стадии заболевания с контролем состояния обструкции мочеточников. Дексаметазон назначают по 3–10 мг/сут в течение 8 нед, затем дозу постепенно уменьшают (каждые 4 дня на 0,5 мг), доводя до поддерживающей (0,5 мг/сут), кортизон по 50 мг в день в течение 3 месяцев.
При необходимости применяют противовоспалительное, антибактериальное, дезинтоксикационное, симптоматическое лечение.
В настоящее время широкое распространение получила следующая схема консервативного лечения РПФ:
∨ преднизолон по 25 мг внутрь в течение 1 мес с последующим постепенным снижением дозы в течение 2–3 мес;
∨ во время приёма преднизолона ежедневно на ночь эзомепразол 20 мг;
∨ вобэнзим♠ по 5 драже 3 раза не менее 6 мес;
∨ после начала снижения дозы преднизолона (через 1 мес) целекоксиб по 100 мг 2 раза в течение 1 мес.
Учитывая, что РПФ практически всегда сопровождается нарушением уродинамики и расширением вышележащих отделов мочевыводящих путей – мочеточника и лоханки, терапия должна проводиться при восстановленном пассаже мочи – антирефлюксном многонедельном внутреннем стентировании верхних мочевыводящих путей. Только в случае непроходимости мочеточника для стента вопрос может решаться в пользу чрескожной нефростомии или того или иного вида открытого оперативного лечения.
Применение консервативных методов лечения часто приводит к улучшению состояния пациентов на фоне восстановления проходимости мочеточника, однако нередко возникает рецидив заболевания с еще более выраженными функциональными и анатомическими изменениями. При нарастании ретенционных нарушений верхних мочевыводящих путей или при далеко зашедшей стадии болезни проводят оперативное лечение.
ОПЕРАТИВНОЕ ЛЕЧЕНИЕ
Оперативное лечение показано при осложнениях РПФ: выраженном одно- или двустороннем расширении мочеточников, особенно если сдавление мочеточника сопровождают его грубая деформация, развитие стриктуры; частых обострениях пиелонефрита; нарастании почечной недостаточности; нефрогенной АГ, так как в этих случаях консервативные методы воздействия не эффективны.
Выбор вида оперативного лечения зависит от локализации, степени распространённости фиброзного процесса, степени вовлечения и распространения поражения мочеточника, функционального состояния почек и верхних мочевыводящих путей.
При ограниченном участке поражения, расположенном в типичном месте (уровень L4–L5), рекомендуется выполнять уретеролиз с последующим перемещением мочеточника из зоны поражения. При перемещении мочеточника в брюшную полость в качестве доступа используют срединную лапаротомию, которая позволяет выполнять вмешательство одномоментно на обоих мочеточниках, в случае билатерального поражения, а также переместить мочеточник с максимальным сохранением его сосудов. Мочеточники перемещают на значительном протяжении вместе с неизмененными отрезками длиной не менее 3–4 см над и под местом видимых границ сдавления. Брюшину под перемещенной частью мочеточника сшивают отдельными кетгутовыми швами, не затрагивая мочеточниковых сосудов, особенно венозных. Перемещенный мочеточник не должен сдавливаться в зоне перехода из одной атомической области в другую. Данная операция не может быть выполнена при тотальном поражении мочеточника и в случае, когда после уретеролиза необходима резекция пораженного сегмента с наложением анастомоза. В этой ситуации предлагают перемещать мочеточник из зоны фиброза во вновь сформированное ложе забрюшинного пространства с предварительным окутыванием мочеточника лоскутом перемизия поясничной мышцы, который не вовлекается в процесс. Следует отметить, что выделять мочеточник целесообразно, не вскрывая лоханки, так как спавшийся мочеточник выделить гораздо сложнее.
Особые трудности возникают при лечении вторичного РПФ, когда мочеточник вовлечён в рубцовый процесс на большом протяжении. В этих случаях хирургу приходится, освобождая мочеточник, нарушать его кровоснабжение и иннервацию, при этом нет гарантии того, что не возникнет рецидив заболевания, так как сама операция неизбежно приводит к новым очагам рубцевания вокруг мочеточника и в его стенке. При распространённом процессе выполняют замещение мочеточника сегментом тонкой кишки. Данная операция показана при отсутствии грубого нарушения тонуса лоханки и деструктивного процесса в сосочках почки. Именно поэтому при тяжёлых проявлениях болезни предложены методы внешнего протезирования мочеточника с помощью сосудистых протезов из дакрона, тефлона, лавсана и других современных материалов (рис. 26-16). Операцию не выполняют при локализации процесса в нижней трети мочеточника, при мочевой инфильтрации околопочечной и околомочеточниковой клетчатки, а также в период острого воспаления. Протезы выполняют роль защиты мочеточника после отведения последнего из зоны фиброза. Для профилактики послеоперационного острого пиелонефрита необходимо внутреннее дренирование верхних мочевыводящих путей с помощью стента с использованием в последующем всех его преимуществ при необходимости длительного дренирования в сочетании с антисклеротической терапией. Для предупреждения перегиба протеза во время движения почки при дыхании его проксимальный конец должен быть установлен не выше 4 см от ЛМС.
При распространённом РПФ без вовлечения в фиброзно-склеротический процесс подвздошных сосудов возможно выполнение аутотрансплантации почки. При значительно расширенных и извитых мочеточниках могут быть выполнены боковая уретерокутанеостомия, нефростомия или длительное стентирование мочеточника.
У ряда больных нефростома порой устанавливается на весьма длительный срок. Критерии текущей оценки состояния больного, а также течения заболевания и контроля проводимого лечения — уровень АД, мочевина и креатинин сыворотки крови, данные ультразвукового сканирования почек (состояние ЧЛС), СОЭ.
При сдавлении аорты и подвздошных артерий проводят артериолиз. Высвобождение сдавленных вен из фиброзной ткани может быть трудным и рискованным вмешательством, а операция шунтирования при обструкции нижней полой вены не является успешной. Поэтому для улучшения оттока венозной крови и купирования симптомов, обусловленных венозной обструкцией, достигают посредством поднятия ножного конца кровати и эластической поддержки нижних конечностей, т.е. ноги держат в приподнятом состоянии и применяют их эластичное бинтование до тех пор, пока не разовьётся достаточная коллатеральная венозная система.
Обострение ХПН самое грозное осложнение в ближайшем послеоперационном периоде. Для лечения проводят интенсивную дезинтоксикационную терапию, вплоть до применения гемодиализа и ультрафильтрации крови, а также назначают антибиотики. Наиболее частое осложнение в отдаленном послеоперационном периоде — повторное сдавление мочеточника в ходе продолжающегося забрюшинного фиброза. Этот факт ещё раз подтверждает необходимость дополнять уретеролиз перемещением мочеточника по той или иной методике.
По данным литературы, послеоперационная летальность составляет 16,7–17,2%, длительный положительный эффект получен у 53–67% прооперированных пациентов.
ДАЛЬНЕЙШЕЕ ВЕДЕНИЕ
Больные с РПФ, как при консервативном лечении, так и после проведенного оперативного вмешательства, подлежат динамическому наблюдению урологом и нефрологом с целью своевременного выявления осложнений заболевания.
Каждые 6 мес необходимо проводить УЗИ почек, общий и биохимический анализы крови, общий анализ мочи. Если необходимо, выполняют экскреторную урографию, прибегают к радиоизотопным методам исследования. При распространении фиброзных изменений в забрюшинном пространстве назначают глюкокортикоиды на срок 3–6 мес и препараты гиалуронидазы, вобензим. В случае выявления инфекции мочевых путей проводят бактериологическое исследование мочи, назначают антибиотики и диуретики растительного происхождения.
При прогрессировании почечной недостаточности, частых обострениях пиелонефрита показано длительное стентирование мочеточника и/или оперативное лечение.
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА (КРАТКИЕ РЕКОМЕНДАЦИИ)
Вести размеренный образ жизни, избегать эмоциональных и физических перенапряжений. Из питания необходимо исключить всё острое и солёное, копчёности, консервированные продукты; ограничьте потребление продуктов с высоким содержанием белка. Употреблять достаточное количество жидкости — рекомендуется пить клюквенный морс и чай из мочегонных трав.
ПРОГНОЗ
Прогноз зависит от стадии заболеваният.е. от характера фиброзного процесса, функционального состояния почек и верхних мочевыводящих путей, наличия осложнений. При консервативном лечении возможен временный положительный эффект. Наилучшие результаты получены при своевременном оперативном лечении с использованием одного из методов перемещения мочеточника. Длительный приём глюкокортикоидов после операции улучшает прогноз. Возможны рецидивы заболевания через несколько месяцев или лет.
Основная причина смерти — почечная недостаточность. В целом прогноз при болезни Ормонда неблагоприятный. В инкурабельных случаях летальность составляет до 60%. Прогноз относительно благоприятен, если лечение начинают до появления необратимых изменений в почках и развития почечной недостаточности.